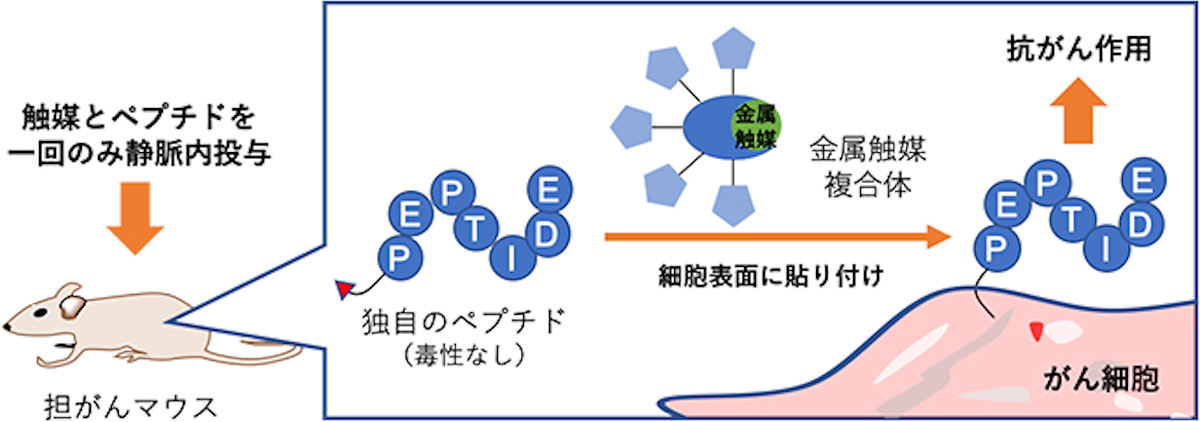
理化学研究所(理研)、東京工業大学(東工大)、日本医療研究開発機構の3者は9月2日、遷移金属触媒を用いて、マウス体内のがん細胞表面に「細胞毒性ペプチド」を貼り付けることにより、腫瘍の成長を抑制し、何もしない場合と比べて2倍近く延命させることに成功したと発表した。
同成果は、理研 開拓研究本部 田中生体機能合成化学研究室の田中克典主任研究員(理研 科技ハブ産連本部 糖鎖ターゲティング研究チーム副チームリーダー/東工大 物質理工学院 応用化学系教授兼任)、同・ペニー・アーマディ特別研究員(研究当時)、同・六車共平客員研究員(東工大 物質理工学院 応用化学系 日本学術振興会特別研究員兼任)、同・チャン・ツンチェ特別研究員、同・坪倉一輝大学院生リサーチ・アソシエイト(研究当時)、同・江河泰子研究補助パートタイマーII、同・堂前直ユニットリーダー、同・鈴木健裕専任技師、岩手医科大学 薬学部の田村理准教授(現・和歌山県立医科大学 薬学部教授)、早稲田大学大学院 理工学術院の中尾洋一教授らの共同研究チームによるもの。詳細は、英国王立化学会の機関誌「Chemical Science」に掲載された。
細胞に対して毒性を示す薬剤(抗がん剤)を投与し、がん組織にダメージを与えることで、がん(悪性腫瘍)の縮小を目指す治療法である化学療法だが、抗がん剤はがん細胞だけでなく正常細胞にも影響を及ぼしてしまい、それが副作用として現れてしまうことが課題とされている。
理想は、正常細胞への影響を極力減らし、副作用を最小限に抑えることで、その実現に向け、さまざまな手法の研究開発が進んでいる。たとえば、抗がん剤を選択的にがん組織に送達する「薬物送達(ドラッグデリバリー)」や、毒性を持たない化合物(プロドラッグ)をがん組織において毒性を示す化合物へと変換する「生体内合成化学治療」などが知られている。
研究チームも、特定の官能基に対して強い親和性を示す遷移金属触媒を用いた「体内遷移金属触媒反応」を利用したプロドラッグの活性化法の開発を行ってきた。一般的に、遷移金属触媒を生体に投与すると、グルタチオンなどの触媒毒によってその機能は失われてしまうとされているが、血清アルブミンタンパク質の疎水性ポケットの中へ遷移金属触媒を導入すると、遷移金属触媒が安定化され、生体内においても効率的に触媒反応が進行することが、田中主任研究員らによって2019年に報告されている。
また、同技術に基づいた体内遷移金属触媒反応により、2021年4月にはがん細胞に抗がん活性物質を貼り付けることで、副作用がなく、がん細胞の増殖やがんの転移を抑制することに成功したことを報告していた。しかしこの時点では、効果が発揮されるまでに複数回の薬物投与が必要という課題があったという。
そこで、今回の研究では、遷移金属触媒を用いたがん細胞表面への貼り付け反応によって抗がん活性を示す化合物の探索が行われた。その結果、そのままでは無毒性(測定範囲内)だが、細胞表面に貼り付けると毒性を示すという、まさに貼り付け方式に適した「細胞毒性ペプチド」の発見に成功。さらに、細胞表面への貼り付け効率のいい反応による治療効果の向上に向け、ルテニウム(Ru)を用いた触媒による新しい反応の開発も行われたという。
この反応は、これまで用いてきた金(Au)触媒による反応と比較して、約20倍ほど効率的に進行することが確認されたという。
実際に、ペプチドとルテニウム触媒によるがん細胞に対する毒性を調べるため、ヒト結腸がん細胞の「SW620細胞」を用いた評価が行われたところ、ペプチド(使用した濃度:600μmol/L)や触媒(使用した濃度:20μmol/L)をそれぞれ単独で作用させた場合は細胞毒性が示されないのに対し、ペプチドと触媒の両方を作用させると毒性を示すことが明らかにされた。
-
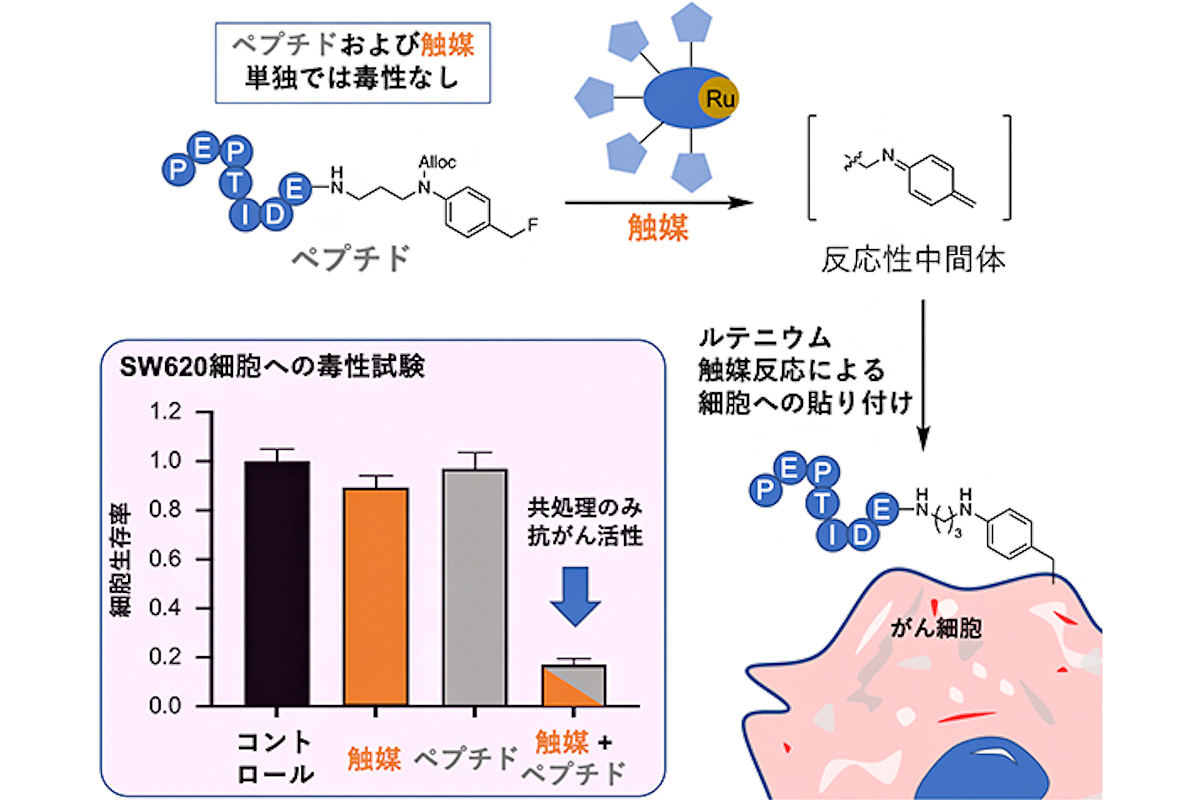
細胞毒性ペプチドとルテニウム触媒を利用した新しい細胞貼り付け反応。細胞毒性ペプチドにはベンジルフルオライド構造が導入されており、ルテニウム触媒によって反応性の高い中間体が生成されるため、がん細胞表面にペプチドを効率的に貼り付けることが可能となる。左下のグラフは、SW620細胞(ヒト結腸がん細胞)での毒性試験の結果。触媒のみ(橙)およびペプチドのみ(灰色)の場合は毒性が示されなかった一方で、触媒とペプチドで共処理する(橙+灰色)と有意な細胞毒性が示された(コントロールに対してp<0.001) (出所:理研Webサイト)
さらに、マウス個体における体内金属触媒反応による細胞毒性ペプチドの治療効果についての評価も実施。SW620細胞を移植した担がんマウスが4群に分けられ、各群のマウスに(1)生理食塩水、(2)触媒のみ、(3)ペプチドのみ、(4)触媒とペプチドの両方をそれぞれ静脈内に1回注射投与が実施され、腫瘍の成長に関する比較が行われた結果、(1)~(3)のマウス群では腫瘍の成長が抑制されず、25日前後で死亡したのに対し、(4)のマウス群では腫瘍の成長が抑えられ、生存期間が2倍近く延長することが確認されたほか、副作用も見られないことが確認されたという。
-

(上)がん移植マウスへの1回投与によるがん治療実験。写真中の矢印(白)ががん部位を示す。生理食塩水、ペプチドのみ、触媒のみでは投与8日後(左の画像)にがんが増殖して大きくなっているのが見て取れる。それに対し、触媒+ペプチドは投与8日後(右の画像)にはがんが抑制され、小さくなっているのがわかる。(左)腫瘍の成長に関するグラフ。触媒+ペプチド以外は右肩上がりに成長していくのがわかる。触媒+ペプチドは9日を過ぎた頃から少し増殖した。(右)生存率に関するグラフ。生理食塩水を投与した対照群では、20日を過ぎた頃には生存率が0%になった。触媒のみやペプチドのみも30日時点で0%に。一方、ペプチドと触媒を共に投与したマウスでは、マウスの生存期間が50日まで延長した。対照群に対して、*p<0.05、**p<0.01、****p<0.001 (出所:理研Webサイト)
研究チームでは、今回の成果を受け、これまでの研究室レベルの小さなスケールの研究から、より現実的ながん治療へと発展させることが可能になったという。今後、生体内合成化学治療の概念が、がん治療における有用な治療基盤の1つとして発展するものと期待できるとしている。