順天堂大学の服部信孝教授、今居譲先任准教授らの研究グループはこのほど、若年性遺伝性パーキンソン病の原因遺伝子として知られているPINK1(ピンクワン)が、同じく原因遺伝子として知られるParkin(パーキン)をすばやく不良ミトコンドリアへ呼び寄せ、効率よく分解する仕組みを持つことを明らかにした。同研究結果は、科学雑誌『PLoS Genetics』に発表されている。
若年性遺伝性パーキンソン病の原因遺伝子としては、同病気を発症する家系の解析からPINK1遺伝子とParkin遺伝子の2つが見つかっていた。これらの遺伝子に傷がつき正常に機能しない場合には、不良ミトコンドリア(※1)が蓄積することで中脳ドーパミン神経(※2)の変性が生じ、パーキンソン病になると考えられているという。
そこで同研究所を含む複数の研究グループは、不良ミトコンドリアが生じるとPINK1とParkin(※3)が共にそれを感知し除去することを明らかにした。その分子メカニズムでは、PINK1がParkinにリン酸を付加(リン酸化)すると、Parkinにスイッチが入りミトコンドリアの分解に働くが、Parkinのリン酸化だけでは、なぜか効率よくミトコンドリアが除去されなかった。同研究所はこのことから、ParkinとPINK1の働きには未解明のメカニズムがあるはずだと考え今回の研究を行ったという。
PINK1は、リン酸化する酵素(キナーゼ)でParkinをリン酸化することで活性化のスイッチを入れるという(※4)。同研究所が6月に発表した「ショウジョウバエ分子遺伝学による研究」から、PINK1によってリン酸化されるタンパク質がParkin以外にもあることが想定されており、京都大学の石濱泰教授との共同研究によりPINK1がリン酸化する新たなターゲットとなるタンパク質を探索し、ユビキチンを同定した。
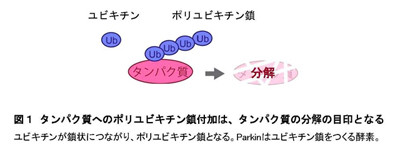
ユビキチンはタンパク質に鎖状に付加(ポリユビキチン化)されることによりタンパク質の分解シグナルとなる特殊なタンパク質だが、PINK1はユビキチンだけでなくポリユビキチン鎖をもリン酸化することがわかったという。
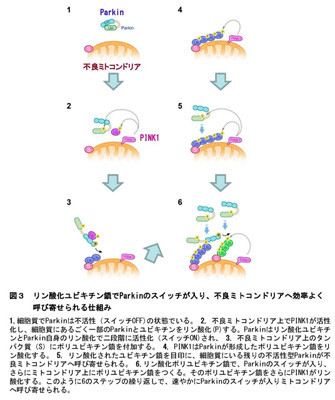
さらに、ミトコンドリア上にリン酸化ポリユビキチン鎖を形成させると、それを目印にParkinが呼び寄せられ、リン酸化ユビキチンやリン酸化ポリユビキチン鎖でParkinの2つ目のスイッチが入ることを明らかに。つまり、PINK1とParkinが協業でミトコンドリア上にリン酸化ポリユビキチン鎖を形成することにより、すばやく残りのParkinが呼び寄せられスイッチが入るという、効率の良い不良ミトコンドリア除去の仕組みを発見したとのこと。
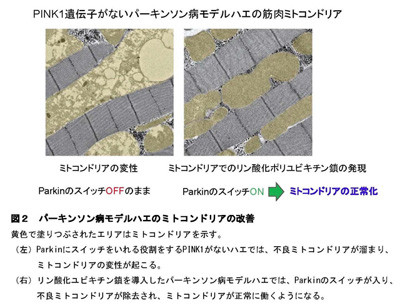
今回の発見に基づき、ミトコンドリアにリン酸化ポリユビキチン鎖を人工的に付加することを試みた結果、パーキンソン病モデルショウジョウバエのミトコンドリアの変性を改善させることに成功したという。
同研究所は、「今後は、PINK1やParkinと同じような作用をしタンパク質のスイッチを操作する人工的な方法を開発し、不良ミトコンドリアの除去によるパーキンソン病の効果的な早期予防に向けて、さらなる研究をしていく予定です」とコメントしている。
※1 ミトコンドリア 細胞の活動に必要なエネルギー(ATP)を作る細胞小器官。不良ミトコンドリアとは、損傷をうけて機能が低下した状態のミトコンドリアを示す。この器官の損傷や老化が進むと、酸化ストレスの原因となる活性酸素種が器官内部から漏えいする。
※2 中脳ドーパミン神経 パーキンソン病において神経変性が起こる神経。この神経が変性するとパーキンソン病で見られる運動機能障害(手足の震え、筋肉の硬直、姿勢制御の障害など)が起こる。
※3 PINK1、Parkin PINK1遺伝子、Parkin遺伝子から作られるタンパク質は、それぞれ同名のPINK1、Parkinと名付けられている。ここでは、遺伝子はPINK1遺伝子、Parkin遺伝子/タンパク質はPINK1、Parkinと表記する。
※4 Parkinの働き Parkinは、ユビキチンというタグをタンパク質に付加する酵素(ユビキチンリガーゼ)であり、ユビキチンを付加されたタンパク質は分解や輸送などさまざまな制御を受ける。