京都大学と科学技術振興機構(JST)は、マウスES細胞から3種類の転写因子を用いて「始原生殖細胞(Primordial germ cells:PGCs)」を誘導する培養系を開発し、さらにそのPGCsから精子を作製し、子供を産み出すことにも成功したと共同で発表した。
成果は、京大大学院 医学研究科の斎藤通紀教授(兼JST ERATO研究総括、京大 物質-細胞統合システム拠点(iCeMS)主任研究者、京大 iPS細胞研究所研究員)と同・博士課程学生の中木文雄氏らの研究チームによるもの。研究の詳細な内容は、英国時間8月4日付けで英科学誌「Nature」オンライン速報版に掲載された。
卵子や精子を生み出す生殖細胞系列は、生体内の細胞系譜の中で唯一次世代に遺伝情報を伝達できる重要な細胞系列であり、その発生異常は不妊や次世代の個体の疾患に深く関わる。すべての卵子や精子の起源となるのが、PGCsだ。同細胞は個体の発生過程の比較的早い段階(マウスの場合は胚齢6.5日)で分化し、さまざまな発生過程を経て、雌では卵子に雄では精子に分化するが(マウスの場合は胚齢12日前後)、その発生過程の多くが胎仔期に行われていることもあり、解明されていない部分が多く残されていた。
また、iPS細胞やES細胞といった多能性幹細胞は、体を構成するいずれの細胞にも分化する能力を持っており、生殖細胞にも分化することが可能だ。多能性幹細胞を任意の細胞に分化させる培養技術を開発することにより、細胞の発生過程を体外培養で再現することができるようになる。これによって、体内では解析困難であった現象を詳細に研究することが可能となるため、発生・細胞・幹細胞生物学分野の研究を大きく前進させると共に、再生医学などの応用分野にも大きく貢献することとなるというわけだ。
昨年までに、研究チームはマウスのiPS細胞やES細胞からPGCsに類似した始原生殖細胞様細胞(Primordial germ cell like-cells:PGCLCs)を試験管内で分化させて、それらを基に健常な精子、卵子と子孫を得ることに成功している。これにより、体外で作製したPGCLCsは機能的な精子・卵子まで分化する能力があることが明らかとなったが、これらの分化を制御するのに十分な遺伝子群は不明だった。今回の研究では、マウスES細胞を起点として、遺伝子を人為的に発現させることにより、PGC様の細胞を誘導し、生殖細胞の運命決定を行うのに十分な遺伝子群を特定することを目的として実験が行われた次第だ。
実験の概要は画像1にある通りである。まず、PGCsが誘導された時に蛍光タンパク質を発現する(レポーター遺伝子を持つ)と共に、目的の外来遺伝子を任意のタイミングで人為的に発現させることが可能なES細胞を樹立。この内、雄の細胞を用いて実験が行われた。
詳細は以下の通りだ。このES細胞は、PGCsに発現する遺伝子「Blimp1」とPGCsや卵子に発現する遺伝子「stella」が発現している場合に、蛍光タンパク質が発現するように遺伝子(レポーター遺伝子)を改変したマウスから樹立された。これは先行研究でも用いられていたものである。これにより、PGCsに分化した細胞は蛍光タンパク質によって光を発するため、蛍光顕微鏡下で容易に観察することが可能だ。
また、人為的な遺伝子発現は、「テトラサイクリン誘導システム」を用いて行われた。このシステムは、テトラサイクリン系抗菌薬を培地に添加することにより、導入した目的の外来遺伝子を任意のタイミングで人為的に発現させることが可能なシステムだ。今回用いたES細胞は、これらレポーター遺伝子とテトラサイクリン誘導システムの両方を備えたものである。
画像1の流れについて大まかに説明すると、まずES細胞を生体内で始原生殖細胞へと分化する組織によく似た特徴を持つ「エピブラスト様細胞(Epiblast-like cells:EpiLCs)」に分化させるところからスタート。EpiLCsを回収し、細胞凝集塊を作製して、3遺伝子を人為的に発現させると、約36時間以降に凝集塊中にPGC様の細胞が誘導される(「Blimp1」および「stella陽性細胞」)。これらの細胞を不妊マウスの精巣に移植すると、約10週間で精子形成が認められ、この精子を体外受精させると仔が得られるというわけだ。
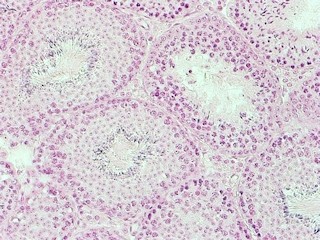
まずはES細胞をEpiLCsに分化させ、細胞が2000細胞程度に凝集された。そして、生殖細胞の運命決定に十分な遺伝子群を特定するため、培地にテトラサイクリン系抗菌薬の1種である「ドキシサイクリン」が加えられ、Blimp1、「Prdm14」、「Tfap2c」という3種類の遺伝子を発現。その結果、レポーター遺伝子が陽性に(画像2)。
陽性率は、「BMP4」などの「サイトカイン」(細胞間で情報を伝達する因子)を利用した従来の方法による誘導効率(約40%)よりも高く、約80%に達し、また48時間以内に両方のレポーター遺伝子が陽性となり、誘導に要する時間も半分程度に短縮された。今回は直接転写因子群が発現させられたため、高効率、短時間での誘導に成功したと考えられるという。
画像2は、遺伝子を用いて誘導されたPGCLCs(TF-PGCLCs)。EpiLCsを回収し、細胞凝集塊を作製して、3遺伝子を強制発現させたもの。それぞれ、(左)明視野、(中)黄~緑色蛍光タンパク質(Blimp1遺伝子の発現を示す)、(右)青色蛍光タンパク質(stella遺伝子の発現を示す)となっている。培養2日目には、凝集塊のほとんどの細胞で緑色、青色蛍光タンパク質が陽性だ。右側は遺伝子を発現させずに培養されたもので、蛍光タンパク質は観察されない。細胞凝集塊の大きさは直径約0.3~0.5mm。
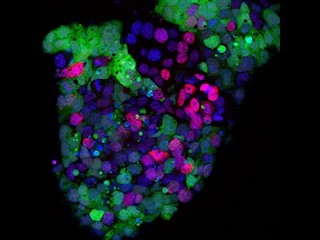
これらのレポーター陽性細胞を、不妊の新生児マウスの精巣に注入すると、10週間後に精子形成が観察された。回収した精子を正常な卵子と体外受精させたところ、健常なマウスが誕生したというわけだ。これらのマウスには導入した外来遺伝子が組み込まれていることも確かめられている。これらのマウスは正常に成長し、雌雄ともに子供を作る能力があることも確認(画像3)。今回、遺伝子により誘導されたPGC様の細胞は、「TF-PGCLCs(Transcription factor-induced primordial germ cell-like cells)」と命名された。
|
|
|
|
|
TF-PGCLCs由来の精子と、体外受精により得られた産仔。画像3(左):画像2で示された蛍光タンパク質陽性の細胞が回収されて不妊マウスの精巣に移植され、10週間経過したところで精巣が摘出されて観察が行われたところ、精子形成が認められた。写真は得られた精子。画像4(中):得られた精子を正常な卵子と体外受精させたところ、産仔が得られた。写真はTF-PGCLCs由来の精子から誕生したマウス(出生直後)。画像5(右):TF-PGCLCs由来の精子から誕生したマウスは正常に成長し、雌雄ともに子孫を作る能力が確認された。写真は、出産直後の雌マウス(約14週齢)とその仔マウス |
||
TF-PGCLCsの遺伝子発現全体を調べるために、「DNAマイクロアレイ解析」が行われた。得られた遺伝子発現情報について主成分分析が行われた結果、従来のサイトカインを用いた方法で誘導した場合は一時的に体細胞への分化プロセスを経てPGCLCsへと分化するのに対し、転写因子を用いて誘導した場合は、体細胞への分化プロセスを経ることなく速やかにPGCLCsへと分化することが判明。なお、ES細胞に直接遺伝子を発現させた場合は、PGCLCsが得られなかったという(画像6)。
画像6は、ES細胞、EpiLCs、TF-PGCLCsなどの遺伝子発現情報を比較した主成分分析の概略図。DNAマイクロアレイ解析によって各細胞種の遺伝子発現が網羅的に調べられ、その発現情報が主成分分析された結果の概略だ。左下のES細胞を起点に、まずエピブラスト様細胞(EpiLCs)へと分化させた後、3遺伝子を発現させると、培養2日目にPGCLCsが誘導される。BMP4などのサイトカインを用いて誘導を行った場合は、体細胞系列に1度近づいた後、培養4~6日目にPGCLCsが誘導される形だ。これらの遺伝子発現の状態は、発生9.5日目のPGCsに近いことが確かめられている。
また、これら3種類の遺伝子を、それぞれ1種類ずつ人為的に発現させることで、各遺伝子が果たしている役割についての検討も行われた。遺伝子発現情報が比較された結果、特にPrdm14遺伝子が、生殖細胞プログラムの誘導において中心的な役割を果たしていることが明らかとなったのである。なお、今回は多能性幹細胞としてES細胞を用いて実験が行われ、iPS細胞を用いた実験は行われていないが、同様の方法でPGCLCsを誘導可能であると考えられるとした。
なお、今回の成果によって、生殖細胞の発生がどのように進んでいくのか、これらの遺伝子を中心に解析することが可能になるという。実際、今回絞り込んだ遺伝子は、生体において生殖細胞の運命決定においてごく初期に発現している。またこの培養系は、生体内で起こる現象を体外で再現する上で基盤となるものとした。
さらに、iPS細胞や、心筋細胞や神経細胞などの体細胞は、特定の遺伝子によって誘導可能であることが示されてきたが、機能的な生殖細胞を誘導した例はなく、今回の成果はほ乳類の生殖細胞が特定の遺伝子によって誘導可能であることを示したものだ。ほかの細胞種では、動物種の垣根を越えて同一の遺伝子群で誘導が可能な場合があるという。
また今回の結果は、ほかの動物、特にヒトにおいて生殖細胞を人為的に誘導する可能性を広げるものだ。ただし、ヒトにおける生殖細胞の研究は、倫理的な課題を慎重に検討した上で実施を判断する必要があるとしている。