大阪大学(阪大)と科学技術振興機構(JST)は12月12日、国立遺伝学研究所(遺伝研)、北海道大学(北大)、京都大学の協力を得て、化学発光タンパク質と蛍光タンパク質をハイブリッド化することで、従来よりも10倍以上明るく光る超高輝度化学発光タンパク質「nano-lantern(ナノ-ランタン)」を開発し、同タンパク質でマーキングすることにより自由行動下におけるマウス体内のがん組織を実時間検出することに成功(画像1)。同時に、ナノ-ランタンを改変して「Ca2+」や「cAMP」、「ATP(アデノシン三リン酸)」を検出できる発光プローブの開発にも成功したと共同で発表した。
成果は、阪大 産業科学研究所 生体分子機能科学研究分野の永井健治教授、遺伝研の堀川一樹准教授、北大大学院 医学研究科の初谷紀幸特任助教、京大大学院 薬学研究科の樋口ゆり子特定助教らの共同研究グループによるもの。研究はJST戦略的創造研究推進事業・個人型研究(さきがけ)「光の利用と物質材料・生命機能」研究領域における研究課題「ナノサイズ高輝度バイオ光源の開発と生命機能計測への応用」によるもので、詳細な内容は、日本時間12月12日付けで英国科学誌「Nature Communications」オンライン速報版に掲載された。
下村脩博士らのノーベル化学賞受賞で知られる蛍光タンパク質を中心とした蛍光プローブの開発・実用化に伴い、生きた細胞や組織、生物個体が生きたままその体内で繰り広げられる生理現象を観察するいわゆる「ライブイメージング」技術が発展を遂げている。2012年度のノーベル生理学医学賞を受賞した山中伸弥博士のiPS細胞研究にも大いに利用されているところだ。
ただし、観察対象がさまざまな動植物種に広がる一方で、同時に蛍光観察に不可欠な紫外線などの励起光照射は細胞に対して毒性を示す上に、観察対象によっては強い自家蛍光や光応答性を有するといった問題が浮上してきた。
そこでこうした問題を回避するべく、今回の共同研究グループの阪大の永井教授らが取り組んでいるのが、励起光の照射を必要としない「生物発光」用いたライブイメージングの開発である。
生物発光とはホタルなどが出す光のことで、「ルシフェラーゼ」と呼ばれる酵素タンパク質の酸化触媒反応により、化学エネルギーを用いて発光基質「ルシフェリン」が発光する現象だ。
生物発光は蛍光と違い外部からの励起光を必要としないため、自家蛍光や光毒性といった問題を回避することができる。このような利点があるにも関わらず、生物発光は蛍光に比べて明るさが足りないという弱点があったためライブイメージングへの応用が進んでいなかったのである。
研究グループでは生物発光を用いてライブイメージングをするために、従来用いられてきた発光タンパク質「改変型ウミシイタケルシフェラーゼ(RLuc)」の明るさを改善することを考案。
そのために、まずRLucのタンパク質安定性を向上させることが知られているアミノ酸変異を導入後、塩基配列に変異が入ったさまざまなDNA断片を大量に得られる「エラー誘発PCR法」を用いてランダムに変異を導入し、さまざまな変異体を作成した。その中から、より明く発光する能力を得たものをそれぞれのスペクトルを測定して選択したのである。
さらに研究グループでは、発光するクラゲなどの刺胞(しほう)動物が、その発光器官内で行っている「生物発光共鳴エネルギー移動(BRET)」という現象を利用して発光の効率を上昇させることに着想を得て、さらなる研究を進めた。
BRETは発光基質が光を放出するために使うエネルギーを近傍にある蛍光タンパク質に移動する現象だ。BRETが起こると結果として、発光タンパク質ではなく蛍光タンパク質が光を放出する。発光タンパク質よりも蛍光タンパク質が光を放出する効率が高い場合、発光量が増える形だ。
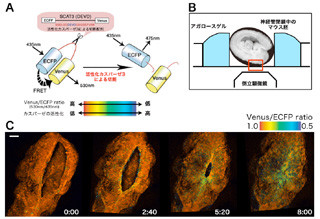
そこで、発光タンパク質と蛍光タンパク質が隣接するような状況を強制的に作るために、両者の融合タンパク質を作成(画像2)。大腸菌に発現させて精製したこの融合タンパク質の発光能を測定した結果、既存のRLucに比べて10倍以上明るく発光することがわかったのである(画像2)。自発的に発光するナノスケールの光源という意味を込めて、ナノ-ランタンと名付けられた。
画像2はナノ-ランタン。(a)従来はRLucに酸化された発光基質は発光効率が低く、480nm(青色)の光を微弱ながら放出する。(b)ナノ-ランタンでは、改変RLucに酸化された発光基質のエネルギーは、隣接する蛍光タンパク質「Venus」に移動。蛍光タンパク質は発光効率が高いため、530nm(黄色)の光を強力に放出する。(c)精製したタンパク質でスペクトルを測定するとナノ-ランタンは従来のRLucよりも10倍以上明るく光ることがわかった。
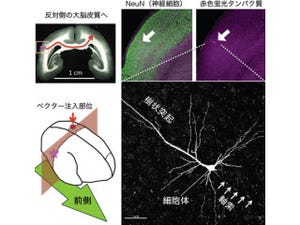
生体内で実際に明るく発光するということを示すために、まず培養細胞での検証が行われた。細胞内の「オルガネラ」に局在するナノ-ランタンを作成したところ、蛍光に遜色ない画像が得られた(画像3)。
次にナノ-ランタンを発現させたがん細胞をマウスの皮下に移植して、生物発光でがん細胞を検出するという実験を実施。これはがん細胞の成長・転移を調べるために、これまでも蛍光や生物発光を用いて行われきた実験だ。
これまでは、蛍光で検出する場合は励起光を当てるためにマウスの毛を剃って光の透過性を上げる必要があった。さらに、生物発光で検出する場合は、マウスが動かないように麻酔をし、暗い環境において長時間露光撮影する必要があったのである。
これらの処置をする必要もなく、ナノ-ランタンを用いることで、自由に動き回るマウスの背中で光るがん細胞の様子をビデオレートで撮影することに成功(画像3)。これはナノ-ランタンを用いることで抗がん剤の評価やがんの転移について、マウスを手術することなく、しかも簡便に評価できることを意味する。
画像2は、ナノ-ランタンのライフサイエンスへの応用。(a)「HeLa細胞」(培養されたヒト由来のがん細胞)の細胞質に局在させたナノ-ランタンの画像。(b)アクチンに局在させたナノ-ランタンの画像。一見ではどちらが生物発光像(左)か蛍光像(右)か見分けがつかない。スケールバーは20μm。(c)がん細胞に発現させたナノ-ランタン(緑色で表示)を移植したマウスのビデオレート撮影と、がん細胞の色を変えて重ね合わせた画像。
さらに、研究グループではこれまで蛍光ではできなかったイメージングを行うため、細胞内で重要な働きを持つCa2+、cAMP、ATPを検出する機能性プローブも作成した。
これはナノ-ランタンの発光タンパク質部分に、Ca2+、cAMP、ATPそれぞれに結合して構造が変わるタンパク質配列を挿入することで作製(画像4)。それぞれを検出する小分子の名前を取って、ナノ-ランタン(Ca2+)、ナノ-ランタン(cAMP)、ナノ-ランタン(ATP)と名付けられている。
画像4は、ナノ-ランタンから機能性プローブの作成の模式図。ここではナノ-ランタン(Ca2+)を例としている。Ca2+に依存して相互作用する「カルモジュリン(CaM)」と「M13ペプチド」を改変RLucの内部に挿入することで、改変RLucをN末端側とC末端側に分割(それぞれ(N)、(C)と表記されている)。
周りにCa2+がない時は発光基質を酸化することができないため光を放出できない。Ca2+がある時はCaMとM13ペプチドが相互作用してコンパクトな構造を取る。これに伴い分割改変RLucが元の構造に戻り、基質を酸化する能力を取り戻す。そして、結果的にナノ-ランタンと同じく530nm(黄色)の光を放出するというわけだ。同様にして、ナノ-ランタン(cAMP)、ナノ-ランタン(ATP1)も開発された。
従来のCa2+プローブでは不可能だった高速度でのイメージングを試見するために、ナノ-ランタン(Ca2+)をHeLa細胞に発現させたところ、これまでの発光性Ca2+プローブでは不可能だったビデオレートでのイメージングに成功した(画像5)。
画像5は、機能性プローブナノ-ランタン(Ca2+)を使ったビデオレートCa2+イメージング。ナノ-ランタン(Ca2+)を発現させたHeLa細胞に対し、ヒスタミン刺激を与えて強制的に細胞内Ca2+濃度を上昇させた。
(a)ヒスタミン刺激後のHeLa細胞の連続画像。ヒスタミンは1と2の間で加えている。細胞内Ca2+濃度上昇の様子が色(緑→赤)でわかる。(b)スケールバーは10μm。細胞内の領域((a)の白い四角内)のCa2+濃度の様子。細胞内Ca2+濃度は一度上昇し、その後、上昇と減少を繰り返す典型的なパターンを示した。
また、蛍光性cAMPプローブよりも大きな変化量を持つナノ-ランタン(cAMP)を用いることで、従来の蛍光性プローブでは変化が小さすぎて検出できなかった多数のアメーバ細胞間で起こるcAMPを介したシグナル伝播のイメージングにも成功している(画像6)。
画像6は、機能性プローブナノ-ランタン(cAMP)を使った多細胞間シグナルのイメージング。(a)10万のアメーバ細胞が集合する際に発するcAMPの波。(b)水色とマゼンタ色で囲まれた領域のcAMP濃度の時間変化。振動して見えるのはcAMPの波が繰り返し発生されるため。
さらに研究グループは、これまで自家蛍光や光応答の問題があるため、蛍光での観察が困難だった植物葉のイメージングにも挑んだ。そして、葉緑体に局在発現させたナノ-ランタン(ATP1)を作成し、光合成でATP産生が起こる様子を観察することに成功したのである(画像7)。
画像7は、機能性プローブナノ-ランタン(ATP1)を使った光合成によるATP産生のイメージング。(a)植物用の葉緑体に局在するCT-ナノ-ランタン(ATP1)の生物発光像、植物葉の自家蛍光像とそれらの重ね合わせ像。重ね合わせ像を観ると、植物葉の自家蛍光は葉緑体に由来することがわかる。よって励起光が必要な蛍光プローブは葉緑体のイメージングに使用することは困難だった。
(b)植物葉に間欠的に光照射する実験が行われたところ(グラフの白い帯の時に光照射が行われた)、光照射時にATP濃度の上昇が確認された。これは葉緑体で光合成により産生されたATPであることがわかっている。
ナノ-ランタンおよびそこから生み出されたプローブは遺伝子にコードされているため、任意の生物の多様な組織における計測を可能にする。ナノ-ランタンを用いることで、特別な処置をすることなくマウスを生物発光で観察できるので、多くの疾病の原因究明やより効果的な創薬スクリーニングが期待されると、研究グループは述べている。
また、励起光を必要としないナノ-ランタンは、光照射により細胞の活動やタンパク質の機能を制御する「光遺伝学的技術」と組み合わせることが容易な点も長所だ。
例えば、神経ネットワークのコントロールと神経活動のモニタリングを同時に行うことができるため、複雑で実験が困難であった高次神経活動(行動、思考、記憶)のメカニズムに迫ることが可能となるとしている。