国立精神・神経医療研究センター(NCNP)は2月24日、神経難病である「多発性硬化症」の患者を対象とする新規治療薬「免疫修飾薬OCH(糖脂質アルファ・ガラクトシルセラミド類似体)」を開発し、同センター病院において多発性硬化症患者を対象とした医師主導治験を開始することをと発表した。成果は、NCNP 神経研究所 免疫研究部の山村隆部長らの研究チームによるもの。
多発性硬化症は主に20~30歳代で発病し、視力障害、運動麻痺、感覚障害などの症状が再発と回復を繰り返す慢性疾患だ。大脳、脳幹、脊髄、視神経など、中枢神経のさまざまな場所に、炎症性の神経組織破壊が繰り返して起こり、徐々に神経変性が進んでいくという疾患だ。遺伝子解析の結果などから、多発性硬化症は関節リウマチや1型糖尿病、シェーグレン症候群などと同様に、自己に反応するリンパ球(T細胞やB細胞)が関係する自己免疫疾患であると考えられ、異常な免疫反応を制御する薬剤の開発が求められている状況だったのである。
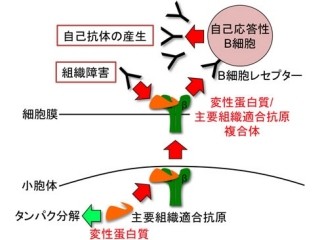
免疫は、ご存じの通り、本来は細菌やウイルスなどの病原体や、悪性腫瘍などを排除する仕組みだが、誤って自分の体の成分に反応して組織障害を起こすことがあり、そのような病態を「自己免疫」といい、それによって起こる疾患のことを自己免疫疾患という。自己免疫疾患では、体のタンパク成分に反応するリンパ球が組織に入って炎症を誘導する。このような病気を誘導するリンパ球に対して、その活動を押さえつけようとする仕組みが「免疫制御機構」であり、免疫制御機構の一翼を担うリンパ球の1つがNKT細胞というわけだ。
山村部長らは多発性硬化症患者の血液中のNKT細胞が著明に減少していることを明らかにし、NKT細胞に作用する薬剤が多発性硬化症の病態を改善する可能性を検討してきた。NKT細胞は抗原提示分子である「CD1d」に結合した糖脂質を認識するユニークなリンパ球で、抗原受容体から刺激が入ると、即座に大量の「サイトカイン」や「ケモカイン」など生理活性物質を産生するのが特徴だ。
NKT細胞の産生するサイトカインには大別して、「インターフェロンγ(IFN-γ)」や「TNFα」などの炎症を促進する炎症性サイトカインと、「インターロイキン(IL)-4」、「IL-5」、「IL-13」などの炎症を抑制する抗炎症性サイトカインのがある。NKT細胞は、状況に応じて炎症性サイトカインまたは抗炎症性サイトカインを産生することによって、リンパ球相互の平衡状態維持や、過剰な免疫・炎症反応にブレーキをかける役割を担い、自己免疫疾患、アレルギー疾患、臓器移植、感染免疫などの広い分野において鍵になるリンパ球というわけだ。
NKT細胞を刺激する糖脂質として最初に同定された物質が、「α-ガラクトシルセラミド(α-GalCer)」で、NKT細胞から炎症性サイトカインと抗炎症性サイトカインの両方を産生させることが可能である。
一方、山村部長らによって現在開発が進められている治療薬のOCHは、α-GalCerの構造に修飾を加えた形で、NKT細胞に抗炎症性サイトカインの優先的な産生を促す活性があり、また経口吸収がよいことから、炎症性疾患の治療薬の候補として注目されてきた。OCHは特定の分子を阻害するのではなく、体内に本来備わった免疫制御機構を促進する作用機序があると推定されるという。
従来の行政区域単位での特区でなく、テーマ重視の特区(複合体拠点の研究者をネットワークで結んだ複合体)として、「医療スーパー特区」がある。平成20(2008)年度より第1弾として「先端医療開発特区」が創設され、最先端の再生医療、医薬品・医療機器の開発・実用化が促進されており、現在国内の24施設が指定されており、NCNPもその内の1つだ。
NCNPでは、平成21(2009)年度よりの医療スーパー特区関連事業として、OCHの医師主導治験の準備を開始。非臨床試験を終了した後、平成24(2012)年11月から平成25(2013)年6月まで「ファーストインヒューマン試験」(第1相試験に相当)として、健常成人がOCHを1回だけ服用する試験(経口単回投与試験)が同センター病院において実施された。
同試験では5グループの被験者(1グループ3名)にそれぞれ異なる量のOCHが投与され、安全性、体内動態、免疫系の変化、治療効果を示すバイオマーカーの検討が行われた形だ。その結果、治療が必要になるような重篤な有害事象は認められなかったという。また多発性硬化症の発症に関係するT細胞や、炎症に関係する遺伝子の発現が低下するなどの所見が認められたとしている。
多発性硬化症患者で減少している血液中のNKT細胞を刺激して増殖させれば、多発性硬化症が改善するのではないかというアイデアを基に、山村部長らは2000年から多発性硬化症の動物実験モデルである「実験的自己免疫性脳脊髄炎(EAE)発症マウス」を使って基礎的な研究を行ってきた。
最初にα-GalCerがEAE発症マウスに投与されて治療効果が調べられたが、病気の改善は見られなかったという。解析の結果、α-GalCerで刺激するとNKT細胞は、抗炎症性サイトカインであるIL-4を産生するが、同時に炎症性サイトカインであるIFN-γを産生し、それがIL-4のEAE抑制効果を打ち消すことが判明した野のである(画像1)。
このような背景から山村部長らは、α-GalCerの構造を一部変えた化合物を複数合成し、治療薬として有望な化合物のスクリーニングを実施した。その結果、脂肪鎖が短い改変体OCHは、NKT細胞のIL-4産生を誘導する活性を保持しながら、IFN-γ産生をほとんど産生させない作用を持ち、α-GalCerよりも治療薬として優れている可能性が推測されたのである。治療実験ではOCHを投与されたマウスでEAEの発症が抑制され、その抑制はNKT細胞の糖脂質による活性化を介するものであることが明らかなった(画像2)。なお、この時の研究成果は2001年にNatureに発表されている。
|
|
|
|
画像1(左):NKT細胞に対するOCHのIL-4誘導効果。画像2(右):多発性硬化症の動物モデルEAEに対するOCHの治療効果 |
|
今回、同センター病院において、健常成人を対象とした本治療薬の医師主導治験を終えたため、次のステップとして患者を対象とした医師主導治験を実施することとなった形だ。同センター病院では3月上旬より、同治療薬を約3ヶ月にわたって3つのグループ(1グループ3名の多発性硬化症患者)に反復投与する治験を開始する予定である。