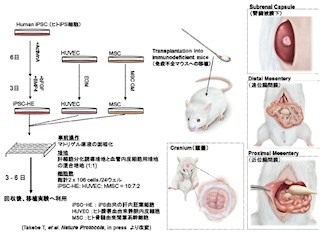
理化学研究所(理研)は1月29日、米ハーバード大学との共同研究により、動物の体細胞における分化の記憶を消去し、万能細胞(多能性細胞)へと初期化する原理を新たに発見し、それをもとに核移植や遺伝子導入などの従来の初期化法とは異なる「細胞外刺激による細胞ストレス」によって、短期間に効率よく万能細胞を試験管内で作成する方法が開発されたと発表した。
成果は、理研 発生・再生科学総合研究センター 細胞リプログラミング研究ユニットの小保方晴子 研究ユニットリーダー、同・研究センターの若山照彦元チームリーダー(現・山梨大学教授)、ハーバード大のチャールズ・バカンティ教授らの国際共同研究チームによるもの。研究の詳細な内容は、日本時間1月30日付けで英科学誌「Nature」に掲載された。
ヒトを含めたほ乳類動物の体は、血液細胞、筋肉細胞、神経細胞など多数多様な種類の体細胞(生殖細胞を除く)で構成されている。しかし、発生を遡ると、受精卵にたどり着く。受精卵が分裂して多種多様な種類の細胞に変化していき、体細胞の種類ごとにそれぞれ個性付けされることを「分化」という。
体細胞はいったん分化を完了すると、その細胞の種類の記憶=「分化状態」は固定される(画像1)。例えば、生体の心臓から細胞を取り出してシャーレの中で培養しても心筋細胞は心筋細胞ままで、分化状態が保持されるという具合だ。つまり、細胞は自分が何の細胞であるかという記憶を保持しているのである。従って、分化した体細胞が別の種類の細胞へ変化する「分化転換」や、分化を逆転させて受精卵に近い「未分化状態」に逆戻りしたりする「初期化」は通常は起こらないとされている。
動物の体細胞で初期化を引き起こすには、未受精卵への核移植を行うクローン技術や、未分化性を促進するタンパク質「転写因子」を作らせる遺伝子を細胞へ導入するiPS細胞技術など、細胞核の人為的な操作が必要になる(画像2)。
一方、植物では、分化状態の固定は必ずしも非可逆的ではないことが知られている。分化したニンジンの細胞をバラバラにして成長因子を加えると、カルスという未分化な細胞の塊を自然と作り、それらは茎や根などを含めたニンジンのすべての構造を作る能力を獲得する。
しかし、細胞外環境(細胞が置かれている環境)を変えるだけで未分化な細胞へ初期化することは、動物では起きないと一般に信じられてきた(画像2)。そこで研究チームは今回、この通説に反して「特別な環境下では動物細胞でも自発的な初期化が起こりうる」という仮説を立て、その検証に挑んだのである。
研究チームはまずマウスのリンパ球を用いて、細胞外環境を変えることによる細胞の初期化を行う際の影響の解析を行った。リンパ球にさまざまな化学物質の刺激や物理的な刺激を加えて、多能性細胞に特異的な遺伝子である「Oct4」の発現が誘導されるかを詳細に検討した。Oct4遺伝子は、ES細胞などの多能性細胞の未分化性を決定する転写因子であり、多能性のマーカータンパク質を作る遺伝子だ。Sox2、Klf4、L-Mycと共に「山中因子」と呼ばれる、iPS細胞の樹立にも必須の因子の1つだ。なお、解析の効率を上げるため、Oct4遺伝子の発現がオンになると緑色蛍光タンパク質「GFP」が発現して蛍光を発するように遺伝子操作したマウス(Oct4::GFPマウス)のリンパ球を使用した。
こうした検討過程で、研究チームは酸性の溶液で細胞を刺激することが有効なことを発見。分化したリンパ球のみを分離した上、30分間ほどpH5.7の酸性溶液に入れて培養(刺激)してから、多能性細胞の維持・増殖に必要な増殖因子である「LIF」を含む培養液で培養したところ、2日以内に初期化が始まり、多能性マーカー(Oct4::GFP)の発現が認められた。7日目に多数のOct4陽性の細胞が出現し、それらの細胞は、細胞塊を形成した(画像3)。
「酸性溶液処理」で多くの細胞が死滅し、7日目に生き残っていた細胞は当初の約5分の1に減ったが、生存細胞の内、3分の1から2分の1がOct4陽性であることがわかったのである。ES細胞やiPS細胞などはサイズの小さい細胞だが、酸性溶液処理により生み出されたOct4陽性細胞はこれらの細胞よりさらに小さく、数十個が集合して凝集塊を作る性質を持っていることが判明した。
次に行われた詳細な検討は、Oct4陽性細胞が、分化したリンパ球が初期化されたことで生じたのか、それともサンプルに含まれていた極めて未分化な細胞が酸処理によって選択されたのかについてである。まず、Oct4陽性細胞の形成過程が「ライブイメージング法」(細胞などが生きた状態でリアルタイムに顕微鏡で観察する技術)によって解析され、すると酸性溶液処理を受けたリンパ球は2日後からOct4を発現し始め(画像3)、反対に当初発現していたリンパ球の分化マーカーの「CD45」が発現しなくなった。またこの時リンパ球は縮んで、直径5マイクロメートル前後の特徴的な小型の細胞に変化したのである。
次に、リンパ球の特性を活かして、遺伝子解析によりOct4陽性細胞を生み出した「元の細胞」の検証が行われた。リンパ球の内、T細胞は1度分化すると「T細胞受容体遺伝子」に特徴的な組み替えが起こる。これを検出することで、細胞がT細胞に分化したことがあるかどうかがわかるというわけだ。この解析から、Oct4陽性細胞は、分化したT細胞から酸性溶液処理により生み出されたことが判明したのである。
これらのことから、酸性溶液処理により出現したOct4陽性細胞は、一度T細胞に分化した細胞が「初期化」された結果生じたものであることがわかった。これらのOct4陽性細胞は、Oct4以外にも多能性細胞に特有の多くの遺伝子マーカー(Sox2、SSEA1、Nanogなど)を発現していたのである(画像3)。また、DNAのメチル化状態もリンパ球型ではなく、多能性細胞に特有の型に変化していることが確認された。
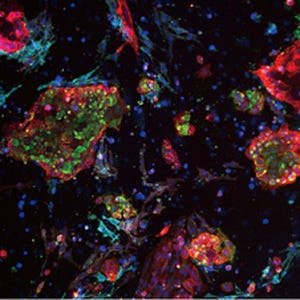
産生されたOct4陽性細胞の検査が行われたところ、多様な体細胞に分化する能力も持っていることが判明。分化培養やマウス生体への皮下移植により、神経細胞などの外胚葉、筋肉細胞などの中胚葉、腸管上皮などの内胚葉の組織に分化することが確認された(画像4)。
さらに、「マウス胚盤胞(着床前胚)」に注入した後にマウスの仮親の子宮に戻されたところ、全身に注入細胞が寄与された「キメラマウス」を作成でき、そのマウスからはOct4陽性細胞由来の遺伝子を持つ次世代の子どもが生まれた(画像5)。
これらの結果は、酸性溶液処理によってリンパ球から産生されたOct4陽性細胞が、生殖細胞を含む体のすべての細胞に分化する能力を持っていることを明確に示しているという。研究チームは、このような細胞外刺激による体細胞からの多能性細胞への初期化現象を「刺激惹起性多能性獲得(Stimulus-Triggered Acquisition of Pluripotency:STAP)」、生じた多能性細胞を「STAP細胞」と名付けた。
続いて検討されたのが、この現象がリンパ球という特別な細胞だけで起きるのか、あるいは幅広い種類の細胞でも起きるのかについてだ。脳、皮膚、骨格筋、脂肪組織、骨髄、肺、肝臓、心筋などの組織の細胞をリンパ球と同様に酸性溶液で処理したところ、程度の差はあれ、いずれの組織の細胞からもOct4陽性のSTAP細胞が産生されることがわかったのである。
また、酸性溶液処理以外の強い刺激でもSTAPによる初期化が起こるかについての検討も実施された。その結果、細胞に強いせん断力を加える物理的な刺激(細いガラス管の中に細胞を多数回通すなど)や細胞膜に穴を開ける「ストレプトリシンO」という細胞毒素で処理する化学的な刺激など、強くしすぎると細胞を死滅させてしまうような刺激を少しだけ弱めて細胞に加えることで、STAPによる初期化を引き起こすことができることがわかったのである。
STAP細胞は胚盤胞に注入することで、効率よくキメラマウスの体細胞へと分化する仕組みを持つ。この研究過程で、STAP細胞はマウスの胎児の組織になるだけではなく、その胎児を保護し栄養を供給する胎盤や卵黄膜などの胚外組織にも分化していることが発見された(画像6)。
STAP細胞を増殖因子「FGF」を加えて数日間培養することで、胎盤への分化能がさらに強くなることも判明。一方、ES細胞やiPS細胞などの多能性幹細胞は、胚盤胞に注入してもキメラマウスの組織には分化しても、胎盤などの胚外組織にはほとんど分化しないことが知られている。このことは、STAP細胞が体細胞から初期化される際に、単にES細胞のような多能性細胞(胎児組織の形成能だけを有する)に脱分化するだけではなく、胎盤も形成できるさらに未分化な細胞になったことを示唆するという。
STAP細胞はこのように細胞外からの刺激だけで初期化された未分化細胞で、幅広い細胞への分化能を有している。一方で、ES細胞やiPS細胞などの多能性幹細胞とは異なり、試験管の中では、細胞分裂をして増殖することがほとんど起きない細胞で、大量に調製することが難しい面があるというわけだ。
研究チームは、理研によって開発された「副腎皮質刺激ホルモン」を含む多能性細胞用の特殊な培養液を用いることでSTAP細胞の増殖を促し、STAP細胞からES細胞と同様の高い増殖性(自己複製能)を有する細胞株を得る方法も確立した(画像7)。この細胞株は、増殖能以外の点でもES細胞に近い性質を有しており、キメラマウスの形成能などの多能性を示す一方、胎盤組織への分化能は失っていることが確認されている。
今回の研究で、細胞外からの刺激だけで体細胞を未分化な細胞へと初期化させるSTAPが発見された(画像8)。これは、これまでの細胞分化や動物発生に関する常識を覆すものだ。STAP現象の発見は、細胞の分化制御に関するまったく新しい原理の存在を明らかにするものであり、幅広い生物学・医学において、細胞分化の概念を大きく変革させることが考えられるという。
分化した体細胞は、これまで、運命付けされた分化状態が固定され、初期化することは自然には起き得ないと考えられてきた。しかし、STAPの発見は、体細胞の中に「分化した動物の体細胞にも、運命付けされた分化状態の記憶を消去して多能性や胎盤形成能を有する未分化状態に回帰させるメカニズムが存在すること」、また「外部刺激による強い細胞ストレス下でそのスイッチが入ること」を明らかにし、細胞の初期化に関する新しい概念を生み出したというわけだ。
また、今回の研究成果は、多様な幹細胞技術の開発に繋がることが期待される。それは単に遺伝子導入なしに多能性幹細胞が作成できるということに留まらない。STAPはまったく新しい原理に基づくものであり、例えば、iPS細胞の樹立とは違い、STAPによる初期化は非常に迅速に起こる。iPS細胞では多能性細胞のコロニーの形成に2~3週間を要するが、STAPの場合、2日以内にOct4が発現し、3日目には複数の多能性マーカーが発現していることが確認済みだ。また、効率も非常に高く、生存細胞の3分の1~2分の1程度がSTAP細胞に変化している。
一方で、こうした効率の高さは、STAP細胞技術の一面を表しているにすぎない。研究チームは、STAPという新原理のさらなる解明を通して、これまでに存在しなかった画期的な細胞の操作技術の開発を目指すという。それは、「細胞の分化状態の記憶を自在に消去したり、書き換えたりする」ことを可能にする次世代の細胞操作技術であり、再生医学以外にも老化やがん、免疫などの幅広い研究に画期的な方法論を提供する(画像8)。
さらに、今回の発見で明らかになった体細胞自身の持つ内在的な初期化メカニズムの存在は、試験管内のみならず、生体内でも細胞の若返りや分化の初期化などの転換ができる可能性をも示唆するという。理研の研究チームでは、STAP細胞技術のヒト細胞への適用を検討すると共に、STAPによる初期化メカニズムの原理解明を目指し、強力に研究を推進していくとしている。