情報通信研究機構(NICT)は12月25日、東京大学の協力を得て、DNAを足場として用いることで生体分子のシステムを作れる技術を開発したと発表。構成部品を混ぜ合わせるだけで、あらかじめ設定しておいた数や並ぶ順番、間隔を持つタンパク質分子のシステムを1度に数多く作製するというものだ。
さらにこの手法を用いて、生物の動きを司るタンパク質分子モーターシステムを作製してその運動を観測し、モーターの種類によって、複数の分子が集まるだけでお互いの活性を上げたり、システムに組み込まれるとごく一部の分子モーターだけが働くようになる現象を示すことを発見したことも併せて発表している。
成果は、NICTの古田健也研究員、同・小嶋寛明室長、東大の豊島陽子教授らの研究グループによるもの。研究の詳細な内容は、12月24日の週に米国科学雑誌「米科学アカデミー紀要(PNAS)」オンライン速報版にて公開の予定。
生体分子は、生体内で複数分子のシステムを形成して働く場合がほとんどであり、システムを形成することで協調しながら効果的に機能を果たしている。細胞内での物質の輸送を司るタンパク質モーターも例外ではない。筋肉や鞭毛の運動、細胞小器官の輸送や細胞骨格ネットワーク構築の例に見られるように、複数の分子が協調して働いている。
細胞内での物質輸送の向き、速度、効率を状況に応じて最適な状態に制御することは、細胞の生存にとって重要だ。これらは輸送システムを構成するタンパク質モーターの種類、状態、構成分子の数によってコントロールされるのである。
これまで、1分子レベルでのタンパク質モーターの性質については、詳細に調べられてきたが、複数分子の協調メカニズムについては、理論的な側面からの研究こそ行われてきたものの、生体分子の数と配置を正確に制御して分子システムを構築して実験に用いることは困難であったため、研究の進展が妨げられていた状況である。
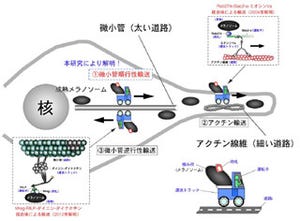
研究グループは今回、DNAの自己組織能を活用することで、構成パーツさえ用意すれば、一定の手順でそれらを混ぜるだけで、所望する構成の生体分子システムを作製できる手法を考案し、組み込まれるタンパク質分子の数と配置を制御した生体分子システムを作製することに成功した(画像1)。
さらに、この手法を細胞内での物質輸送や運動を司るタンパク質分子モーターに適用し、DNAの足場上に分子数や分子間隔を制御したタンパク質分子モーター(「kinesin-1」、「Ncd」)を用いた、生体分子システムを作製したのである(画像2)。
画像2は、自己組織的な分子システム構築法。酵素タグ(SNAP-tag、HaloTag)が認識する人工基質(リガンド)を導入した1本鎖DNA断片を、テンプレートとなるDNA鎖と塩基配列特異的に結合させ、2本鎖DNAの足場を形成する。次に、酵素タグを末端に持つ生体分子と混合し、自己組織的に分子システムを構築する。
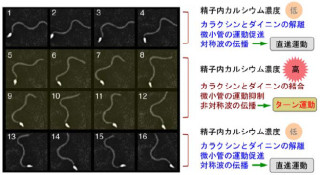
基板表面に固定したレールの役割を持つタンパク質フィラメント(微小管)上でのそれらの運動を蛍光顕微鏡下で観測した結果、生体分子システムを構成する分子の数を1個から2個に増やす、あるいはシステムを構成する分子の間隔を狭くするだけで、運動効率が上昇することが見出された(画像3・4)。
また、微小な力を測定できる特殊な光ピンセット装置を用いてシステム全体が発生する力の測定も行われ、「kinesin-1」は、分子を何個か集めても、常に1個分の力しか出さないことが解明されたのである。
今回の結果は、複数のタンパク質分子モーターが狭い空間に詰め込まれると、それだけで互いの運動の活性を上げたり、システムを構成する分子の数の変動に対しても安定して力を出したりする自己調整機能を有することを示したもので、細胞内での物質輸送や細胞骨格ネットワーク形成に際して、タンパク質モーターの離合集散の果たす役割を理解する上で重要な手がかりを与えるものだ。
基礎研究の観点からは、今回の成果を、鞭毛運動モデル、筋収縮モデルや細胞骨格ネットワーク生成モデルなど、多数の分子が協調して働く生体システムを人工的に再構成するための手法として発展させ、その動作メカニズムの理解を深めるために活用することが期待されるという。
応用的な観点からは、タンパク質分子をこれまでにない高い精度で配置し、システム化することを通じ、受容体タンパク質を利用したセンサやタンパク質モーターを利用したアクチュエータなど、生物の優れた機能をそのまま保有した、新しいデバイス構築を実現するための基盤技術としての活用が期待されるとも、研究グループは述べている。