理化学研究所(理研)は8月30日、細胞のカルシウムイオン(Ca2+)チャネル「IP3レセプター」の開口メカニズムを解明したことを発表した。
理研脳科学総合研究センター発生神経生物研究チームの御子柴克彦チームリーダー(JST戦略的創造研究推進事業 発展研究SORSTの「カルシウム振動プロジェクト」研究総括)、篠原理研究員、および分子神経形成研究チームの道川貴章副チームリーダーらによる共同研究の成果で、成果は米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America:PNAS」オンライン版に掲載された。
カルシウムというと、一般的なイメージでは骨の主成分だが、細胞内情報伝達物質としても重要な役割を担っている。細胞内のCa2+の濃度は、通常、細胞外のわずか1万分の1程度に保たれており、細胞質に浮かぶ小胞体の中に蓄えられている。しかし、細胞外からさまざまな刺激が加わると、Ca2+は刺激に応じて小胞体から放出され、細胞質中のCa2+濃度は一過性に増加する仕組みだ。
このように細胞は細胞質中のCa2+濃度を時間・空間的に多様なパターンで変化させることで、神経の興奮、筋収縮、分泌、受精、免疫応答、細胞の運動、細胞死など、多岐にわたる生理現象をコントロールしている。
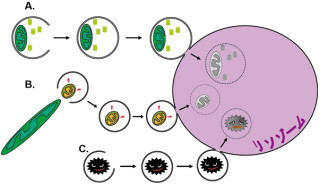
一般に、細胞外からの情報は、刺激物質が細胞表面のレセプターに結合することで細胞に伝えられ(画像1・A)、刺激を受け取った細胞は「イノシトール三リン酸」(IP3)を産出する仕組みを持つ。IP3は細胞内に存在する小胞体膜上に存在し、Ca2+を放出するコックの役目であるIP3レセプターと結合して、細胞質中のCa2+濃度上昇を引き起こす。これまでに、神経細胞のような興奮性の細胞が示す活動電位というスパイクの生成メカニズムについては、「ホジキン・ハックスレー方程式」によってその本質が理解されてきた。
しかし、非興奮精細胞を含むより広範な細胞種が示す「Ca2+振動」については、関与するIP3レセプターが小胞体上に存在するため、生きた細胞内でチャネル分子の働きを測定することができず、本質的な生成メカニズムがわかっていなかったのである。
研究グループは、IP3レセプターは同一タイプのサブユニットもしくは異なるタイプのサブユニット4つで構成する「四量体」を形成してイオンチャネルとして働いていることから、今回は「タイプ1」と呼ばれるサブユニットに青色蛍光たんぱく質、あるいは黄色蛍光たんぱく質を融合させたIP3レセプターを作製し(画像1・B)、子宮頸がん由来のヒト培養細胞である「Hela細胞」に発現させた。
作製した融合たんぱく質は、野生型レセプターと同様に、「IP3結合活性」、「IP3誘導Ca2+放出活性」、「四量体形成活性」、および細胞質中のCa2+濃度に依存して二相生にCa2+放出活性変化させる「Ca2+感受性」を保持しており、小胞体上には選択的に局在することを確認した(画像1・C)。これらから、蛍光たんぱく質を融合させたIP3レセプターは、生きた細胞内でイオンチャネルとして働くと推察されたのである。
実験では、まず2種類の蛍光たんぱく質と融合させたIP3レセプターを、遺伝子導入により同じHela細胞に同時に発現させた。2種類の蛍光たんぱく質で標識したサブユニットを含む四量体のIP3レセプターでは、レセプター分子の構造変化に伴って蛍光たんぱく質間の距離や角度が変化し、その結果両者間のFRET効率が変わると予想されていた。
そこで薬剤処理により細胞膜を透過性にして、数十ナノモル(nM)から数マイクロモル(μM)程度でさまざまな濃度のIP3およびCa2+を別々に添加し、2種類の蛍光たんぱく質間のFRET効率の変化を蛍光顕微鏡により計測した。その結果、IP3添加でFRET効率は有意に上昇する一方で(画像2・A、C)、Ca2+添加でFRET効率は減少することが判明したのである(画像2・B、D)。このことは、IP3結合によりIP3レセプター内で標識部位であるアミノ末端領域は近づくように構造変化を起こすこと、一方Ca2+結合により標識部位は遠ざかるように構造変化を起こすことを示す。
さらに、IP3とCa2+を同時に添加すると、それぞれ単独で添加した場合の単純な和を超えて、FRET効率が変化することも確認された(画像2・E)。特に、IP3およびCa2+存在下で測定したFRET効率変化から、Ca2+だけで生じたFRET効率変化を差し引くと、IP3レセプターの開口状態を表す信号を抽出することが可能であることがわかったのである(画像3)。この結果から、IP3レセプターを構成する4つのサブユニットのアミノ末端領域間の相対位置が、チャネルの開口状態と相関があることも判明した。
そして研究グループは、取得したFRET効率変化からIP3やCa2+がIPレセプターと結合した時のIP3レセプター開口モデルも構築(画像4)。ほかのイオンチャネルとは異なるユニークな分子機構を持つことを明らかにした。ほかのイオンチャネルは、チャネルが一度開口してから不活性化状態へ移行するというメカニズムを持つ。しかし、IP3レセプターでは開口メカニズムと不活性化メカニズムが互いに独立しており、かつ一方へ進むと他方への移行が妨げられる排他的な関係にあるという独特な分子機構を持っていたのである。
今回の結果は、Ca2+スパイク形成の分子機構を定量的に明確にすることで、シナプス可逆性や細胞死などのさまざまな生命現象を制御しているカルシウムによる情報符号化のメカニズムの解明にもつながるとした。