東北大学は、癌治療において、放射線やシスプラチンが効く機構を発見したと発表した。
同研究は、東北大学加齢医学研究所フェローの安井明氏(東北大学名誉教授)によるもので、同研究成果は、英国時間8月28日「Philosophical Transaction of the Royal Society (Biology)」誌に掲載された。
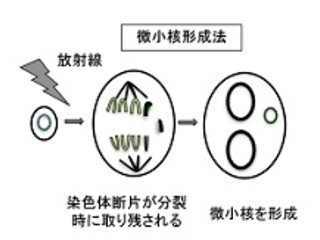
ヌクレオゾームリモデリングは、ATPを代謝してエネルギーを作るATPアーゼを含む多数の因子が複合体を作って、DNAとヒストン等が一体となったクロマチン(ヌクレオゾーム)の転写を容易にする機能で、これにより細胞に必要な蛋白質が必要な時に作られるようになっている。この機能は、DNA損傷の修復の際にも、修復を行なう蛋白質が働き易い環境を作り出すという事が知られていたが、どの因子がどの損傷の修復に関わっているかは明らかではなかった。
安井氏は過去に、BAF複合体のどの因子が二重鎖切断の修復に関わっているかを示し、その8個の因子がシスプラチンへの耐性にも重要であることを示している。また、これらの因子が癌細胞で最も高頻度(癌の20%)に変異していることも明らかになってきた。今回の研究では、BAF因子の放射線、紫外線、及びシスプラチンへの感受性を詳しく解析。その結果、BAF因子欠損細胞はとりわけシスプラチンに高感受性で、70%以上のシスプラチンで生じるDNA損傷が細胞死につながることが明らかになった。細胞死は癌細胞で変異が高頻度に起きるp53という蛋白が重要な役割を果たしているが、BAF因子とp53の変異の分布に重複は見られず、少なくとも初期の癌においてはBAF因子の変異細胞はシスプラチンに高感受性であると考えられるという。
これまで、シスプラチンは経験的に良く効く薬剤として広く癌治療に使われてきたが、その理論的根拠は示されておらず、同研究成果はその理論的説明を与え、癌治療の効率化につながり、とりわけ初期の癌治療の効果を向上させることが期待できるという。また、DNA修復の能力は癌細胞や老化細胞でも通常細胞や若い細胞と変わらないにも関わらず、歳とともに癌が頻発し老化が加速する現象に対し、同研究成果は、DNA修復をサポートする機構が歳と共に弱体化してDNA損傷が十分に修復されず、細胞死や変異を産み出すことがその理由になりうることを提唱した。