横浜市立大学(横浜市大)は11月8日、特定の場所で受けた恐怖体験の記憶が形成される際に、これを仲介する分子を特定したと発表した。
成果は、横浜市大 大学院医学研究科 生理学の高橋琢哉教授らの研究チームによるもの。研究の詳細な内容は、日本時間11月12日付けで英オンライン科学誌「Nature Communications」に掲載された。
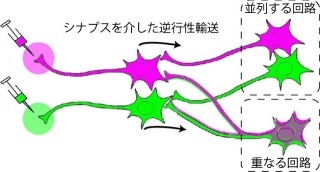
ヒトの脳は外界からの刺激に応答して変化していく仕組みなのは誰もが知るところだ。こうした脳の機能を「可塑性」という。神経細胞と神経細胞をつなぎ、神経細胞間の情報伝達の中心を担っている構造体が「シナプス」だ。ある神経細胞が活性化すると、その神経細胞のシナプス前末端より神経伝達物質が放出され、別の神経細胞にあるシナプス後末端にある受容体に結合することにより情報が伝わる(画像1)。脳に可塑的変化が起こる時、このシナプスの応答が増強するといった変化が見られるというわけだ。
脳内シナプス伝達において中心的な役割を担っている神経伝達物質の1つは「グルタミン酸」であり、「AMPA受容体」はその受容体の1つだ。AMPA受容体にグルタミン酸が結合すると、イオンチャネルを形成しているAMPA受容体が活性化し、イオンが細胞内に流入する。このイオンの流入がシナプス応答になるのだ。従って、シナプスにおけるAMPA受容体の数が増えることにより、シナプス応答が大きくなるのである。このようなシナプス応答の増強は、記憶学習をはじめとした脳内情報処理の変化の中心的メカニズムだ。
動物が新しいことを経験してシナプスに可塑的変化が起こる時、このAMPA受容体はイオンチャネルを活性化するだけでなく、シナプス後膜に移動するというアクションも見せる。またこれまでの研究から、シナプス応答の増強は、「シナプス後膜へ向かってAMPA受容体が移動する数の増加による」ということも明らかになっており、AMPA受容体のシナプス移行が脳可塑性の分子基盤の1つである、というコンセプトは世界的に認められているところだ。
海馬は記憶の中枢として知られており、長い間にわたって大きな注目を浴びてきたが、研究チームによる以前の研究で、トラウマ記憶が形成される際にAMPA受容体のシナプス移行が海馬において起こることを発見しており、なおかつそれこそがトラウマ記憶形成に必要な現象であるということも発見していた。
そして今回、海馬に依存した恐怖記憶が心に刻まれる時に起きるAMPA受容体のシナプス移行が、神経伝達物質の1つである「アセチルコリン」の増加により仲介されているということを明らかにしたのでる。なおアセチルコリンは、現在のアルツハイマー病治療においてもその脳内での量を増加させるという手法が採用されており、人間の認知機能に重要な役割を果たす分子として注目されている。
研究チームは今回の研究において、ウィルスを用いた生体内遺伝子導入法、電気生理学的手法、行動学的手法を駆使し、ラットを用いて海馬に依存した恐怖記憶(Inhibitory avoidance task)が獲得される過程で、AMPA受容体の1つである「GluA1」が海馬における「CA3」領域から「CA1」領域にかけて形成されるシナプスに移行してシナプス応答が強化されるが、この現象がアセチルコリンの分泌増加により仲介されていることを明らかにしたというわけだ。
Inhibitory avoidance taskとは、明るい箱と暗い箱を隣接させて両方の部屋をラットが自由に行き来できるようにする。ラットが暗い部屋に入った時に電気ショックを与えるとラットは暗い部屋に入らないようになる。この過程でラットは暗い部屋における電気ショックという恐怖記憶を獲得することになるのである(画像2)。
|
|
|
画像2。恐怖条件付け(Inhibitory avoidance task) |
今回の研究は、トラウマ記憶形成のカギとなる仲介分子を特定したものだ。今回の研究はPTSD(心的外傷後ストレス障害)などの心の傷に起因した社会性障害などの精神障害をコントロールする新薬開発の糸口になると期待されるとしている。