慶應義塾大学(慶応大)は12月13日、東京大学、長崎大学の協力を得て、ピロリ菌由来のがんタンパク質「CagA」が「がん幹細胞」に注入されると、細胞内にCagAを溜め込み、安定的に存在することを証明したと発表した。
成果は、慶応大医学部 内科学(消化器)の鈴木秀和准教授、同・医学部 先端医科学研究所 遺伝子制御研究部門の佐谷秀行教授、東大医学部 微生物学の畠山昌則教授、長崎大 熱帯医学研究所 細菌学分野の平山壽哉教授らの共同研究グループによるもの。研究の詳細な内容は、米国医学雑誌「Cell Host & Microbe」2012年12月号に掲載された。
胃がんは、日本では罹患率が非常に高く、部位別死亡数では2番目に多いがんだ。胃がんの重要な危険因子としてピロリ菌感染がある。ピロリ菌感染によって胃がんが発症する最も重要な要因といわれているのが、CagAというピロリ菌の産生する毒素の関与だ。
CagAはヒトの胃の粘膜の細胞の中に、ピロリ菌の「IV型分泌機構」を使って打ち込まれた後に、発がんに至るシグナルを誘導する。従って、細菌由来の「がんタンパク質」であるという認識だ。
疫学的にも、CagAを作るタイプのピロリ菌の感染が、CagAを作らないタイプのピロリ菌の感染に比較して、圧倒的に胃がんの発症と関係していることがわかっている。
CagAによって細胞ががんになるには、細胞内でCagAが安定的に存在し続け、がん化シグナルを惹起し続ける必要があるが、細胞内に打ち込まれたCagAが果たして安定して存在できるかについては、実際にはわかっていなかった。
今回の研究では、まず培養した胃の細胞にピロリ菌を感染させ、細胞内に打ち込まれたCagAの安定性を継時的に検討。その結果、細胞内のCagAは時間と共に減少し、安定して存在し続けていないことが判明したのである。
そこで、どのような機序によって細胞内のCagAが分解されているのかが調べられた。その結果、もともとは細胞が持つ、細胞内のタンパク質を分解する仕組みの1つである「オートファジー(自食作用)」が作動し、これによって細胞内に打ち込まれたCagAが分解されていることがわかったのである。
続いて、どのようにしてCagAを分解するオートファジーが作動するかが調べられた。ピロリ菌は、CagAのほかに、菌体外へ分泌されて、細胞に空胞を形成する空胞化毒素「VacA」も産生しているが、VacAを作らないタイプのピロリ菌感染では、CagAを分解するオートファジーは作動せず、またVacAをCagA発現細胞に直接添加すると、CagAを分解するオートファジーが作動することが確認されたのである(画像1・上)。
さらに、VacAはヒトの胃の粘膜の細胞の表層にある「lipoprotein receptor related protein-1(LRP1)」という受容体に結合した後、細胞内の抗酸化物質「グルタチオン」を減らすことで細胞内での活性酸素種「ROS」の蓄積を誘導。それにより「Akt-MDM2-p53」タンパク質分解の経路が活性化されることで、CagAを分解するオートファジーが作動することが判明した(画像1・上)。
以上のことから、ピロリ菌自らが、VacAを用いて細胞内に打ち込んだCagAを、オートファジーの作動を介して分解することで、細胞内CagA量を抑制的に調節していることがわかったのである。
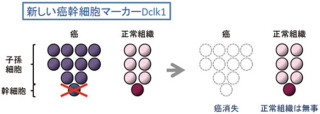
そこで研究グループが考えたのが、感染しているヒトの胃の細胞のキャラクターが細胞内でのCagAの安定性に影響を与えることがないかどうかというもの。がん幹細胞のマーカー分子の1つである「CD44variant9(CD44v9)」発現細胞(画像2)では、シスチントランスポーター「xCT」細胞膜上で安定化し、細胞内グルタチオンを高め、酸化ストレス、つまり活性酸素に対して抵抗性を示すという特性が知られていた。
今回の研究では、このCD44v9が発現する胃がんのがん幹細胞ではVacAによるCagAを分解するオートファジーが作動しないことがわかったのだ。その結果、CagAはCD44v9を発現する「がん幹細胞」に特異的に蓄積することが明らかとなった(画像1下・2)。
つまり、細胞内に打ち込まれたCagAの安定性は、ピロリ菌に感染したヒトの胃粘膜の細胞のキャラクターによって決定され、がん幹細胞の性質を持つ細胞に特異的に蓄積することで、発がんシグナルを惹起し続けていると考えられたのである。
近年、臨床疫学的研究の結果からもピロリ菌と胃がんの関連は、益々濃厚になってきているところだ。しかし、ピロリ菌感染から胃がん発症までには、数10年の歳月がかかること、感染者の内の胃がん発症者は、ほんの一部であるということから、直接的な胃がん発症の分子機構の解明が求められていた。
今回の成果は、ピロリ菌によって細胞内に打ち込まれたCagAは、通常ならオートファジーによって分解・排除されるが、CD44v9を発現するいわゆる「がん幹細胞」では、細胞内にCagAを溜め込んでいくことが示され形だ。
この成果から、CD44v9の発現状況を調べることが、ピロリ菌感染に伴う胃がんの発症のリスクやピロリ菌の除菌後の胃がん発症のリスク、さらには、胃がんの再発リスクを評価するときの重要な指標になり得ることが期待できるという。
また、今回の研究では、ピロリ菌の分泌毒素VacAによるCagAを分解するオートファジー誘導の仕組みが解明された。オートファジーは、元来細胞が持っているタンパク質分解システムであり、細胞内での異常なタンパク質の蓄積を抑制している。
つまり、強制的に一過性のオートファジーを誘導させることで細胞内CagAの排除促進をもたらすことができ、ピロリ菌感染時の胃がんの発症予防が可能になることも期待できるという。
さらに、生体内にもがんタンパク質は存在し、これらのタンパク質が蓄積することは細胞のがん化を誘導する。従って、一時的にオートファジーを誘導し、がんタンパク質の蓄積を抑制することによる発がん予防は、胃がんに限らずほかの臓器での発がん予防への応用も期待できるとした。
現在、日本では、ピロリ菌の除菌療法が、胃潰瘍・十二指腸潰瘍、早期胃がんの内視鏡治療が行われた後の胃、胃マルトリンパ腫、特発性血小板減少性紫斑病に対して、保険適用の治療となっている。今回の研究結果により、これらの前駆病変である「慢性萎縮性胃炎」でピロリ菌の除菌療法を行えば、胃がん発症の予防に一層つながることが期待されるとした。