早稲田大学(早大)は、京都大学(京大)と大阪大学(阪大)の協力を得て、がん抑制タンパク質複合体「FANCI-FANCD2複合体」の機能を解明することに成功したと発表した。
成果は、早大理工学術院の胡桃坂仁志教授、同・佐藤浩一大学院生、京大放射線生物研究センターの高田穣教授、同・石合正道准教授、阪大学生命機能研究科の木村宏准教授らの共同研究グループによるもの。研究の詳細な内容は、「The EMBO Journal」に掲載の予定だ。
FANCI-FANCD2複合体は高発がんを伴う重篤な遺伝病の原因遺伝子産物であり、ヒトの体内ではがんを抑制する役割を果たしていることがわかっていたが、そのメカニズムは明らかになっておらず、重要な研究対象として世界中でその機能が注目されていた。
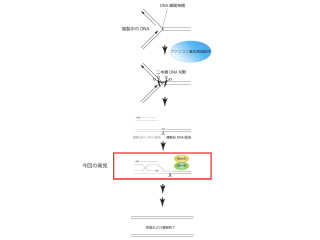
生物の遺伝情報であるゲノムDNAは、ヒトにおいては2mにも及び、それが約直径5μmの細胞核に収納されている(画像1)。遺伝情報はできるだけ正確に受け継がれなければならないが、常に損傷を受けているのがDNAだ。
このDNA損傷は、紫外線や放射線はよく知られているが、さらには飲食や呼吸ですら原因となって引き起こされる。もしDNA損傷がそのままにされてしまうと、細胞はがん化してしまう。そうしたDNA損傷に対処するために、ヒトをはじめとするあらゆる生物はDNA修復反応を進化させてきたのである。
近年になって、多くの遺伝子疾患の原因がDNA修復の異常に起因することが明らかになってきた。そうした中で、非常に重篤な遺伝子疾患として知られているのが「ファンコニ貧血」だ。
ファンコニ貧血は、先天的に再生不良性貧血を発症し、さらに高い頻度でがんを発症してしまう。この疾患は、DNAの酸化やアルコールの摂取などで生じる「DNA鎖間架橋」というDNA損傷の修復異常によって引き起こされる。
この疾患の保因者は300人に1人とかなり高い割合が見積もられており、潜在的な患者も多いという。ファンコニ貧血の原因遺伝子は15個見つかっており、これらの遺伝子産物が恊働してDNA鎖間架橋修復を行い、細胞をがん化から防いでいると考えられている一方で、そのメカニズムは不明なままだった。
これは、ファンコニ貧血原因遺伝子産物であり、DNA鎖間架橋修復で中心的な役割を担っているFANCI-FANCD2複合体の機能が明らかになっていないことが大きく影響している。そのため世界中でこのタンパク質複合体の機能の探索が行われてきた。
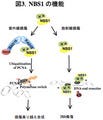
研究グループは今回、世界で初めてこのFANCI-FANCD2複合体の機能を明らかにすることに成功。通常、DNA修復を行うためには、修復タンパク質がDNA損傷に集積し、修復反応を触媒する必要があるが、このことは細胞の中では容易ではない。
長大なゲノムDNAを小さな核に収納するため、ヒトをはじめとした真核生物ではゲノムDNAをヒストンタンパク質に巻き付けてコンパクトに折り畳んでいるが、このヒストンタンパク質が修復タンパク質の集積や修復反応を妨げるためだ。
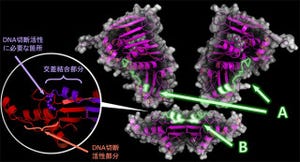
研究グループの研究の結果、FANCI-FANCD2複合体は修復の際に邪魔となるヒストンタンパク質をDNAから出し入れする活性を有していることが明らかになった(画像2)。従って、FANCI-FANCD2複合体によってDNA損傷周辺のヒストンが取り除かれることで、DNA修復が容易になり、がん化が抑制されていると考えられるという。
これらの成果は、ファンコニ貧血の発症メカニズム、さらには発がんメカニズムの解明に対し重要な知見を与えることに留まらず、新規の抗がん剤開発、そして将来的な遺伝子診断に対しても重要な手がかりを与えるものと、研究グループはコメントしている。