東北大学は5月9日、微生物由来のポリ環状エーテル「ガンビエロール」の分子右半分に相当する人工類縁体を設計・合成し、本化合物が天然物と完全に同等の「電位依存性カリウムイオンチャネル(Kvチャネル)」阻害作用を示すことを明らかにしたと発表。
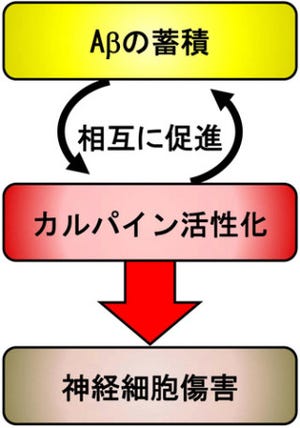
さらに、本化合物をアルツハイマー病モデルのトランスジェニックマウスの初代培養神経細胞に添加すると、アルツハイマー病の原因物質と考えられている「アミロイドβペプチド」や「異常リン酸化タウタンパク質」が減少することが見出されたことも発表した。
成果は、東北大大学院生命科学研究科の不破春彦准教授、佐々木誠教授らのグループと、スペイン・サンチアゴ大学コンポステーラ校のLuis M. Botana教授のグループとの共同研究によるもの。研究の詳細な内容は、5月2日付けで米化学会誌「Journal of the American Chemical Society」に掲載された。
人類は長い歴史の中で、植物や微生物の抽出物に含まれる薬効成分など、天然由来の有機化合物(天然物)を医薬資源として活用してきた。また近年では、有機化合物を用いて複雑な生物現象を分子レベルで制御・解析する、ケミカルバイオロジーと呼ばれる研究領域が脚光を浴びており、天然物は自然科学の広範な領域で重要な役割を期待されている。
一方で、生産生物から微量しか得られない希少天然物も数多く知られており、化学合成による実践的な化合物供給法の開発や、天然物を基盤とした新しい生体機能分子の開発が望まれている状況だ。
海洋生物である単細胞藻類の1種の「渦鞭毛藻」が生産するポリ環状エーテル天然物は、環状エーテルが数ナノメートルに渡ってハシゴ状に連なる「巨大」分子構造を特徴とし、強力な生物活性を発現することが知られている。
ガンビエロール(画像1)もポリ環状エーテルの1つだ。フランス領ポリネシアのガンビエ諸島で採取できる渦鞭毛藻の「Gambierdiscus toxicus」より単離される。ガンビエロールはマウス致死毒性成分で、珊瑚礁海域で年間約2~5万人の中毒患者が発生する食中毒「シガテラ」に関与する神経毒であることが示唆されていた(有毒成分が食物連鎖を通じて魚介類に蓄積し、それらを摂取すると、消化器系及び神経系の中毒症状が現れる)。
またガンビエロールはKvチャネルに特異的に結合し、極低濃度で阻害することが知られている。Kvチャネルは細胞膜中に存在するイオンチャネルの1種で、膜内外の電位(膜電位)の変化を感受して開閉し、カリウムイオンを選択的に通過させる仕組みを持つ。
ガンビエロールのようなポリ環状エーテルは、チャネルタンパク質の構造・機能の理解と制御に有用な化合物と期待されている。そのことからポリ環状エーテルを基盤とした生体機能分子の開発が進められているが、前述したようにナノメートルサイズの巨大な構造を持つことから、有機化学者にとって極めて挑戦的な課題だ。
さらに、ガンビエロールは極微量成分であり、生産生物からの安定的な化合物供給が困難であるため、その生物活性の発現機構は長らく解明されていなかったのである。
これまでに研究グループでは、「鈴木-宮浦カップリング反応」を活用した独自のポリ環状エーテル構築法に立脚してガンビエロールの完全化学合成を世界に先駆けて達成し、化学合成による化合物供給を実現した。
その結果、ガンビエロールがKvチャネルに特異的に結合し、極低濃度で阻害することを明らかにしたのである。一方で、ガンビエロールはナノメートルサイズの巨大複雑分子であり、本天然物を基盤とした生体機能分子の開発は極めて挑戦的な課題として残ったというわけだ。
研究グループは、ガンビエロールのマウス致死毒性には分子右末端の構造が必須であるのに対し、分子左末端の構造が重要でないことを既に明らかとしていた(画像1)。そこで、ガンビエロールのKvチャネル阻害作用には分子右半分が重要であり、分子左半分は簡略化できると作業仮説を立てたのである。
この仮説を実証するべく、研究グループはガンビエロールの分子左側の構造を単純化した、人工類縁体を設計・合成した(画像2)。そしてBotana教授のグループとの共同研究で、研究グループが設計した化合物が、天然物と完全に同等のKvチャネル阻害作用を示すことが見出された次第である。
また、今回の化合物をアルツハイマー病モデルのトランスジェニックマウス(今回のものは非変異型と比較して、アルツハイマー病の原因物質と考えられているアミロイドβペプチド(Aβ)及び異常リン酸化タウタンパク質の蓄積量が顕著に増大させられている)の初代培養神経細胞に添加すると、Aβペプチドや異常リン酸化タウタンパク質が減少することを明らかとした(画像3・4)。
なお、Aβペプチドとは、βアミロイド前駆体タンパク質(βAPP)が、「タンパク質分解酵素β」及び「γセクレターゼ」によって順次切断されて生成するペプチドで、主として40及び42残基のAβ40及びAβ42ペプチドが知られている。この内、Aβ42ペプチドが自己凝集性と神経細胞毒性が高い。そのため、アルツハイマー病患者の病理所見である老人斑の形成や、神経細胞死を引き起こしていると考えられている。
また、タウタンパク質は「微小管結合タンパク質」の1種だ。細胞骨格の安定化に寄与しているが、異常リン酸化されたタウタンパク質が神経細胞内に蓄積すると、アルツハイマー病脳の神経病理学的特徴である神経原線維変化が起こるとされている。
画像3の見方だが、左の棒グラフは、白抜きのバー(NonTg)が野生種のマウスの細胞内のAβの量で、黒(3xTg-AD)が何も添加していないトランスジェニックマウスの細胞のAβの量、そして右端のグレー(3xTg-AD1)がトランスジェニックマウスの細胞にガンビエロール10μモル(μM)を添加したものだ。Aβの量が約45%減少している(バーの上のT字は、誤差の幅を示したもの)。
そして右のグラフは、トランスジェニックマウスの細胞外のAβの量を表したグラフだ。黒(3xTg-AD)が何も添加していないトランスジェニックマウスの細胞のAβの量、グレー(3xTg-AD1)がガンビエロールを10μM、グレーの縦縞(3xTg-AD2)は画像2の中段のガンビエロール人工類縁体の7環性のものを0.1μM、そしてグレーの横縞(3xTg-AD3)は画像2の下段の4環性の人工類縁体を5μM添加した結果である。いずれも減少していることがわかるはずだ。
画像4は異常リン酸化タウの蓄積量の変化を示したもので、こちらも同様で、白抜きのバー(NonTg)が野生種、黒が(3xTg-AD)何も添加していないトランスジェニックマウスとなる。そして3種類のグラフのそれぞれ右端のバーは、トランスジェニックマウスの細胞にそれぞれ添加した結果の値である。左のグラフのグレー(3xTg-AD1)ガンビエロール(10μM)を、中央のグレーの縦縞(3xTg-AD2)が人工類縁体7環性(0.1μM)を、右のグレーの横縞(3xTg-AD2)が同4環性(5μM)を添加したものだ。こちらもAβと同様に、減っているのがわかる。
そして、これらの効果が「N-メチル-D-アスパラギン酸(NMDA)型グルタミン酸受容体」を介したものであることを示唆する知見が得られた形だ。なおNMDA型グルタミン酸受容体とは、中枢神経系を中心に広く存在する神経伝達物質「グルタミン酸」の受容体の1種で、NMDAが作動薬として選択的に作用するのが特徴だ。
今回の実験に対し、研究グループは、今後、化合物の構造最適化や動物実験を進めることで、ポリ環状エーテル天然物の構造をモチーフとした、新たな生体機能分子や創薬シーズの発見に結びつく可能性があると、コメントしている。