理化学研究所(理研)は、iPS細胞(人工多能性幹細胞)などの幹細胞を培養する時に必要になる、生きた「フィーダー細胞」の代わりに、化学固定化したフィーダー細胞を用いる方法を開発し、マウスのiPS細胞でその有用性を実証したと発表した。
成果は、理研基幹研究所伊藤ナノ医工学研究室の岳暁珊(ユエ・シャオシャン)国際プログラム・アソシエイト(現米国ノートルダム大学博士研究員)、伊藤嘉浩主任研究員らと、脳科学総合研究センター動物資源開発支援ユニットの高橋英機支援ユニットリーダー、東京工業大学フロンティア研究機構の赤池敏宏教授らの共同研究グループによるもの。詳細な研究内容は、米オンライン雑誌「PLoS ONE」に3月2日付けで掲載された。
iPS細胞やES細胞(胚性幹細胞)をはじめとする幹細胞は、多様な細胞に分化できる性質(多分化能)と増殖性(自己増殖能)を持つため、再生医療、創薬開発などへの応用が期待されている。
特にiPS細胞は、ES細胞が抱える倫理的な問題や拒絶反応の問題を解決できると考えられており、多分化能を維持したまま効率よく増殖させることができる、安心・安全な培養方法の開発が求められている状況だ。そして、これまでそうした幹細胞をシャーレ上で培養するのに必要だったのが、増殖のための栄養を供給し、多分化能を維持するのに適した環境を整える生きたフィーダー細胞だった。
フィーダー細胞は、増殖や分化を起こさせようとする細胞の培養条件を整える時に補助の役割を果たすほかの細胞種のことだ。通常フィーダー細胞には、あらかじめ死なない程度に抗生物質を投与したりガンマ線を照射したりして増殖しないようにする。ES細胞培養の場合は、マウス胎仔由来の線維芽細胞が用いられるが、実験の目的や細胞によってさまざまな細胞種がフィーダー細胞として用いられる仕組みだ。
しかし従来の方法では、フィーダー細胞に異種動物由来の細胞がそのまま用いられているため、臨床応用での混入の危険性が指摘されると共に、技術的に煩雑な工程や「継代培養」(細胞が増殖して密度が高くなりすぎたり、培地中の栄養分がなくなったりした時、細胞の一部を新しい培地に移し、再び培養を行うこと)ごとの調製が必要だった。
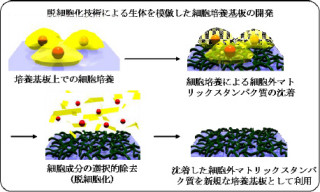
また、マウス由来のフィーダー細胞がヒト由来の幹細胞表面をマウス様に修飾することもわかってきたため、新たな合成基材や培養液の開発が進められている状況だ。研究グループはこうした問題の解決を目指し、化学的に固定化したフィーダー細胞を用いて、新しいiPS細胞培養法の開発に取り組んだというわけである。
2006年と2007年に、研究グループは、「グルタルアルデヒド」や「ホルムアルデヒド」で化学固定化したフィーダー細胞を用いて、ヒト「造血幹細胞」(血球系細胞に分化可能な幹細胞のことで、ヒトの成体では主に骨髄に存在し、白血球、赤血球、血小板、肥満細胞、樹状細胞を生み出す)やマウスES細胞を培養できることを明らかにしてきた(画像1・2)。
生化学や形態学といった生物学分野では、生物試料を自己分解や腐敗から防ぐため、固定とよばれる化学的な処理を行う。グルタルアルデヒドは固定力が強く、細胞の微細構造を正確に保存することができるため、特に透過型や走査型電子顕微鏡で観察する際には基本的な固定液として広く使用されている。
一方のホルムアルデヒドは、高い反応性や細胞透過性を持つ試薬のため、細胞内のタンパク質や核酸の可逆的な架橋剤として、また、細胞や組織の固定液として広く使用されている物質で、水溶液はご存じの「ホルマリン」。細胞内への浸透の速さではホルムアルデヒドだが、固定力はグルタルアルデヒドの方が強い。
|
|
|
|
従来法と化学固定化法で処理したフィーダー細胞による幹細胞培養法の比較。画像1(左)の従来法は、継代ごとに調製が必要な上、増殖した幹細胞を取り出す時、フィーダー細胞が混入する恐れがある。画像2の化学固定化法は、ホルムアルデヒドやグルタルアルデヒドなどの固定化剤でフィーダー細胞を固定化するため、幹細胞への混入を防ぐことができる |
|
今回、同様の方法でマウス胚性線維芽細胞に由来したフィーダー細胞を化学固定化して、マウスiPS細胞の培養床として用いた。具体的には、フィーダー細胞をグルタルアルデヒド水溶液やホルマリンに室温で30分浸して化学固定化したのである(画像3)。
画像3マウス胚性線維芽細胞由来のフィーダー細胞を処理した様子で、5つの顕微鏡画像は、(A)従来法である抗生物質(マイトマイシンC)による処理。(B)と(C)はグルタルアルデヒドによる固定化(B)とその拡大図(C)。(D)と(E)はホルムアルデヒドによる固定化(D)とその拡大図(E)だ。
この培養床でマウスiPS細胞を培養したところ、転写因子の1つで幹細胞の分子マーカーでもある、胚性幹細胞に多能性という性質(未分化状態)を与える主要因のタンパク質「Nanog」(画像4)や、幹細胞の種類に共通した分子マーカーとして広く用いられており、アルカリ性条件下でリン酸エステル化合物を加水分解する酵素「アルカリフォスファターゼ」の発現を確認した。特にグルタルアルデヒドで固定化した場合には、同じフィーダー細胞を3回再利用しても、95%近い細胞が多分化能を維持することも判明している。
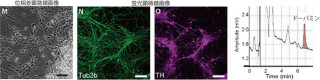
画像4はマウス由来のフィーダー細胞で培養したマウスiPS細胞の多分化能をとらえたものだ。(A)、(B)抗生物質(マイトマイシンC)で処理したフィーダー細胞上のマウスiPS細胞。(C)、(D)グルタルアルデヒドで固定化したフィーダー細胞上のマウスiPS細胞。(E)、(F)ホルマリンで固定化したフィーダー細胞上のマウスiPS細胞。(G)、(H)ゼラチン上のマウスiPS細胞。
なお画像4は、多分化能の指標となるNanogに緑色蛍光タンパク質(GFP)を導入し、マウス胚性線維芽細胞由来のフィーダー細胞で培養したマウスiPS細胞の状態を「位相差顕微鏡」(染色しないで観察できる光学顕微鏡)と蛍光顕微鏡で調べたものだ。
従来の抗生物質で処理した場合と同様に、グルタルアルデヒドやホルムアルデヒドで化学固定化した場合でも多分化能を維持していることがわかる。一方、ゼラチン上で培養した場合は、フィーダー細胞がないため適切な環境が整わず、多分化能が失われた。
次に、培養したマウスiPS細胞の多分化能を調べるために、シャーレ上で神経細胞へと分化誘導させると狙い通り分化が進むこと、7週齢のマウスの皮下に移植すると4週間後には1cm程度の「三胚葉」(外胚葉、中胚葉、内胚葉の総称)を含む「テラトーマ」(奇形腫のことで、神経、皮膚、筋肉など、さまざまな組織が混在)を形成していること(画像5)を見出し、マウスiPS細胞が確かに分化能力を維持していることを実証した。
画像5は、抗生物質(マイトマイシンC)、グルタルアルデヒド、ホルムアルデヒドそれぞれで処理したマウス胚性線維芽細胞由来のフィーダー細胞を用いて、マウスiPS細胞を7継代培養した。次に、7週齢のマウスの皮下に移植し、4週間後にテラトーマをヘマトキシリン・エオジン染色で観察。テラトーマ中に三胚葉を認識した(矢印)。
それぞれの画像は、上段が抗生物質(マイトマイシンC)処理のフィーダー細胞で培養したiPS細胞が形成したテラトーマ。中断がグルタルアルデヒド固定化のフィーダー細胞で培養したiPS細胞が形成したテラトーマだ。厳談がホルムアルデヒド固定化のフィーダー細胞で培養したiPS細胞が形成したテラトーマである。
こうして、化学固定化したマウス由来のフィーダー細胞は培養床として十分な機能を持つことが確認されたというわけだ。固定化により幹細胞への混入を防ぐことができるため、異種動物由来のフィーダー細胞を用いる時に懸念される混入を回避できる。また、凍結乾燥して長期間保存できること、必要な時に解凍して使用できることも確認された。
今後は、この化学固定化したフィーダー細胞が、ヒトiPS細胞へも適用可能かどうか検討していきくと、研究グループは述べた。また異種動物の細胞を用いない、つまり化学固定化したヒト由来のフィーダー細胞でヒトiPS細胞を培養する、より安心・安全で効率的な幹細胞培養法の確立も目指していくとした。