放射線医学総合研究所(NIRS)と科学技術振興機構(JST)は1月10日、鶴見大学の協力を得て、iPS細胞とES細胞の「免疫原性」について解析を行い、両者に差がないことを明らかにしたと共同で発表した。
成果は、NIRS研究基盤センターの荒木良子室長、同・安倍真澄特別上席研究員、鶴見大歯学部の二藤彰教授らの共同研究グループによるもの。研究の詳細な内容は、日本時間1月10日付けで英国科学雑誌「Nature」オンライン版に掲載された。
京都大学の山中伸弥教授らが開発したiPS細胞は、ES細胞と同様にあらゆる組織に分化する能力を持っており、病気の研究・薬の開発への利用、さらには再生医療の材料として期待されている。iPS細胞の再生医療における最大の利点は、受精卵を使うES細胞と異なり、倫理的な問題点を回避できることもそうだが、患者本人の皮膚などの体細胞から作れるという点である。
免疫反応は、外部から侵入した細菌やウイルスなどを異物とみなし排除しようとする機構だが、この機構は、治療のために移植された他人の細胞に対しても多くの場合反応してしまう(拒絶反応)。よって、自分の体細胞から作ったiPS細胞を利用すれば、拒絶反応が起きない再生医療の実現が可能であると期待されたのである。
ところが2011年5月、米カリフォルニア大サンディエゴ校の研究チームより、その期待を裏切るかのような実験結果が報告された。マウスのiPS細胞を元のマウスに移植したときに、異物として認識され、リンパ球による免疫反応が誘導されてしまったというものだ。
一方でES細胞ではそのような現象は観察されなかったため、iPS細胞の異常性がクローズアップされ、再生医療への利用に慎重さが求められる状況となったのである。
しかし、米国のチームの実験にはES細胞が1株しか用いられていないこと、また実際に医療に用いる場合は分化細胞を移植するにも関わらず、iPS細胞そのものを移植したこと(iPS細胞・ES細胞を移植するとさまざまな分化細胞を成分とする奇形腫という腫瘍を形成する)などの解析手法の問題点、そしてさらなる解析の必要性が議論されていた。
一方、荒木室長らの研究グループはこれまでの研究で、iPS細胞とES細胞のさまざまな性状比較を行う目的で、遺伝的に均一と考えられる近交系マウス(個体が違っても自家移植のモデルとして使うことができる)からiPS細胞とES細胞を多数樹立している。
iPS細胞樹立には腫瘍形成リスクが高いウイルスベクターを用いず、山中教授のグループが報告した「プラスミドベクター」による方法により、ゲノムにベクターが入り込んでいない細胞株を選別。そして、樹立したiPS/ES細胞については多分化能を確認した上で実験に用いた形だ。
今回の研究では、まず前出の米国のチームによる研究と同様、奇形腫形成率を比較。iPS細胞7株とES細胞5株について、同じ系統のマウスの皮下に10回ずつ未分化の細胞を移植し、腫瘍の出現頻度、出現した場合は腫瘍の大きさの変化が調べられた。すると、両者に有意な差は見られなかったのである(出現頻度はiPS細胞82.9±2.9%、ES細胞74.0±5.1%)。
また、移植による免疫反応を確認するために、腫瘍へリンパ球がどれぐらい集まっているかの定量的な解析も行われた。その結果、両者ともリンパ球による免疫反応はほとんど誘導されず、生じても極めて軽微であることが判明。このことは、先行研究とは異なりiPS細胞とES細胞に対する免疫反応に差がないことを示しているという。
次に、完全に分化させた組織を用いた移植実験による比較が試みられた。移植利用を想定すると、試験管内でiPS/ES細胞から分化させた組織・臓器を移植する方法が実際的だが、その方法はまだ研究途上で確立されてはいない。
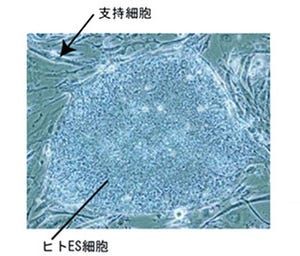
そのため、分化の不完全性が免疫反応を引き起こすファクターとして加わりかねないことから、研究グループは正常組織を作るために、iPS/ES細胞からマウス個体を作成し、個体から皮膚および骨髄細胞を採取した(画像1)。
このようにして得られた組織を同じ系統のマウスへ移植して観察を実施したところ、iPS細胞とES細胞から分化させた細胞の両者において皮膚および骨髄共に、長期間定着していることが確認されたのである(画像2)。
画像2が実験のマウスだ。GFP(緑色蛍光タンパク質)を作るiPS細胞からマウス個体を作出し、その皮膚(5mm×5mm)を同系マウス(GFPを作らない)の背部2箇所に移植。すると、長期間の定着が観察された。写真は移植後約1カ月のもので、緑色に光る部分が移植片である。
さらに、米国のチームによる先行研究においてiPS細胞における免疫反応を引き起こす原因として挙げられていた「Hormad1」や「Zg16」という遺伝子についても解析が行われた、
先行研究の解析では、iPS/ES細胞の移植に伴い、拒絶を受けて縮小しているように見える奇形腫や皮膚組織が観察され、それらの組織において、Hormad1やZg16遺伝子が異常に活性化するというデータが示されている。しかし、今回の研究グループの解析では、自家移植組織において、Hormad1やZg16遺伝子の活性化をほとんど検出することはできないという結果が出た。
今回の研究の特徴は、ヒトでは行うことができない実験を、iPS/ES細胞からマウスの個体を作成し、そのマウス個体から得た組織を用いるという理想的な条件で実験が行われたことだ。
今回の研究成果により、iPS細胞も自家移植の場合に拒絶を考慮する必要がないことが示され、臨床応用の前提条件が確認できたといえるという。このことにより、iPS細胞を利用した治療、例えば、重度の放射線障害のように骨髄の機能不全により血液細胞の減少が生じ、感染症や出血が原因で死に至る場合への血液の細胞の再生による治療などの応用が期待されるとした。
今回の研究では、iPS細胞とES細胞に有意な差は認められなかったが、研究グループは今後もさまざまな角度から両者の性質の違いについて調べる予定としている。