広島大学と東京医科歯科大学(TMDU)は10月23日、細胞周期を利用した正確で安全な「CRISPR-Cas9(クリスパーキャスナイン)」によるゲノム編集を実現する技術を開発したと発表した。
同成果は、広島大大学院医系科学研究科の松本大亮助教、同・野村渉教授、TMDU生体材料工学研究所の玉村啓和教授らの共同研究チームによるもの。詳細は、「Communications Biology」にオンライン掲載された。
ゲノム(全遺伝子の情報)編集技術は、遺伝子を修復できる技術として世界中で研究開発が進められている。中でも、ゲノム編集を大きく進展させたといわれるのが、DNAを切断するための“ハサミ”ことCRISPR-Cas9だ。元々は、外来遺伝子を切断する機能を持つ原核生物の獲得免疫のひとつで、それをベースに開発された。開発者の独・マックス・プランク感染生物学研究所のエマニュエル・シャルパンティエ所長と、米・カリフォルニア大学バークレー校のジェニファー・ダウドナ教授の女性ふたりが、2020年のノーベル化学賞を受賞したことからもCRISPR-Cas9に対する評価が高いことがわかる。
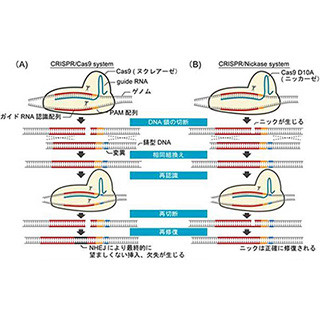
しかし、CRISPR-Cas9にも課題は存在する。例えば、タンパク質に特定の変異を導入したい場合や、均一な変異を導入したい場合は、細胞外部から変異配列を指定するDNAを同時に導入して、「相同組み換え」が行われるようにする必要がある。ところが、この相同組み換えの効率が低く、ゲノム編集技術において今後の解決すべき課題のひとつとなっている。
なお、相当組み替えとはDNAを列車に例えるとわかりやすい。5両編成の列車があったとして、3両目の普通車を切り離して、グリーン車と入れ替えて再び連結して5両編成とするようなイメージだ。入れ替えるDNAの長さは一緒だが、塩基配列が変更されており、結果として作られるタンパク質が異なるなどDNAとしての機能が異なることになる。これに対し、例えば3両目を切り離したあと、入れ替えずに同じ車両かつ同じ位置のまま再び連結し直すことは「非相同組み換え」という。
またCRISPR-Cas9は、標的とする遺伝子配列に類似する配列を誤って編集してしまう「オフターゲット作用」の危険性があることも課題だ。DNAはアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類の塩基で構成されるため、標的とする遺伝子配列に類似する配列は、ゲノム上に多数存在する可能性が高い。そのため、誤ってしまう危険性があるのだ。
オフターゲット作用が起きた場合、重要なDNAが書き換わってしまう可能性があり、ほかのタンパク質の生産や、そのほか遺伝子機能への悪影響が懸念される。オフターゲット作用をいかに低減させることが、ゲノム編集の安全性を向上に直結しているのだ。
そうした中、共同研究チームが今回開発したのが、細胞周期によってCRISPR-Cas9の活性が調節される仕組みである。CRISPR-Cas9に対して、阻害作用を持つ分子「Anti-CRISPR」と、細胞周期に応答して発現量が変化する分子「Cdt1」をつなげることで構築された。細胞周期とは、ひとつの(母)細胞がふたつの娘細胞に分裂するまでに起きる一連の現象のことで、G1、S、G2、Mと4つの決まった順番の期がある。
なおAnti-CRISPRは元々はファージ(細菌に感染するウイルスのこと)が持つタンパク質で、宿主が持つCRISPR-Casを阻害して宿主細胞内で生存するために使われる。細菌が対ファージ用に手に入れたCRISPR-Casに対し、ファージはそれを無効化するためのAnti-CRISPRを手にした。激しい自然の競争がうかがい知れる一幕だ。
一方のCdt1は、細胞周期において、染色体の複製が正確に1回だけ行われることを保証するライセンス化制御因子のひとつ。一度複製された染色体が再複製されないように制御しており、その発現はG1期に高く、S期では低くなる。
今回開発されたシステムは、細胞周期のうち、相同組み換えが起こりやすいS期とG2期において、CRISPR-Cas9が活性化されて相同組み換えが起こるというものだ。その結果、正確に変異が導入された細胞が得られる割合が、最高で5倍程度向上することが確認されたという。
また同時に得られる効果として、オフターゲット作用が最大で90%程度低減されることも見出された。これまで、このふたつの効果を同時に得られる技術は報告された例がないとしている。
CRISPR-Cas9以外にも複数のCRISPR-Casシリーズがあり、それらが多様なゲノム編集技術として実用化に向けた研究が進められている。CRISPR-CasシリーズそれぞれにAnti-CRISPR分子が存在することから、今回開発された技術はそれらすべての組み合わせに適用できる可能性があるという。共同研究チームは今後、それらを実験的に実証し、将来的に利用されることになるゲノム編集についてすべて適用されるような幅の広い技術として確立していくとしている。