京都大学は、「シナプス後膜」内外での「AMPA受容体」の動態を可視化できる新実験手法を開発し、学習・記憶の基盤メカニズムである「長期増強」時のAMPA受容体の変化を観察できるようになったと発表した。成果は、京大理学研究科の平野丈夫教授、同大学院生の田中洋光氏らの研究グループによるもの。詳細な研究内容は、日本時間3月23日付けで米国のオープンアクセスジャーナル「Cell Reports」に掲載された。
ヒトが何かを学習する時、また記憶が形成される時には、神経細胞間で情報を伝える部位である「シナプス」において、情報伝達の効率が変化すると考えられている。この情報伝達効率の変化の内、最も注目されているのが長期増強と呼ばれる現象だ。
情報伝達が頻繁に行われるシナプスでは、伝達効率が亢進し、その状態が持続する。シナプスでは、情報を伝える神経細胞から「グルタミン酸」などの神経伝達物質が放出され、情報を受け取る細胞の細胞膜(シナプス後膜)上に存在する受容体に結合することで、情報が伝えられる仕組みだ。
なお、長期増強が起きる際には、シナプス後膜において、グルタミン酸受容体である「AMPA受容体」の数が増加することが重要である。しかしながら、長期増強の発現に際して、複数種あるAMPA受容体が、いつどのような経路を通りシナプス後膜で増加するかは不明だった。
そこで研究グループは、シナプス後膜内外でのAMPA受容体の動態を可視化できる新実験手法を開発した上で、長期増強時のAMPA受容体の変化を調べることにしたのである。
研究グループは、蛍光標識したAMPA受容体を高シグナル・ノイズ比、高分解能で観察するために、カバーガラス表面直近(約100nm以内)の蛍光に限って検出できる「全反射顕微鏡」を利用することにした。
また、全反射顕微鏡を有効に活用するために、シナプス後膜をガラス面上に直接形成させることを考案。そして、シナプス形成誘導能を有するタンパク質「ニューレキシン」(シナプス前神経細胞にあり、シナプス後膜のニューロリジン分子と結合することでシナプスの形成を引き起こす)でガラスをコートし、その上に神経細胞を培養することにより、シナプス後膜をガラス面上に直接形成させることに成功したのである(画像1)。
|
|
|
画像1。ガラス面をニューレキシンでコートして、その上に海馬神経細胞を培養することにより、シナプス後膜をガラス面上に形成。これにより、シナプス後膜近傍の蛍光を全反射顕微鏡で定量的に調べることが可能となった |
次に、蛍光標識したAMPA受容体を神経細胞で発現させ長期増強を引き起こして、受容体の動態を調べた。受容体が細胞内から細胞膜へ移るエキソサイトーシス、および受容体の細胞膜上でのシナプス後膜への側方移動などを観察できたというわけだ。
ところで、AMPA受容体は、「GluA1」、同2、同3、同4の4種類の「サブユニット」(タンパク質を形成する部品)が適切な組み合わせでタンパク質「四量体」を形成したものだ。なお、四量体には、同一ではないサブユニットが4個集まってできる「ヘテロ四量体」と同一のサブユニットが4個集まってできる「ホモ四量体」がある。
今回用いた脳の「海馬」領域の神経細胞では、GluA1とGluA2およびGluA2とGluA3で作られる2種類のヘテロ四量体がシナプス伝達を担うことがわかっていたが、各々の長期増強時の動態は不明だった。
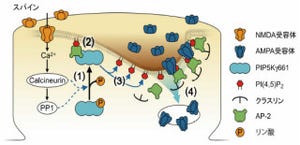
また、GluA1のみで形成されるホモ四量体の長期増強への関与については、研究者間で見解が分かれてもいたため、GluA1、GluA2、GluA3それぞれを蛍光標識して神経細胞で発現させて、それらの動態を調べる実験も実施(画像2)。
それにより、GluA1ホモ四量体、GluA1/GluA2ヘテロ四量体、GluA2/GluA3ヘテロ四量体が、長期増強の発現に際して、異なるタイミングで別経路を通ってシナプス後膜に集積することを明らかにすることができたというわけだ(画像3)。
|
|
|
|
画像2。細胞膜上でのみ蛍光を発する分子(オレンジの星印)を融合したAMPA受容体を海馬神経細胞で発現させた |
画像3。長期増強発現に際して、各型のAMPA受容体が3段階を経て、シナプス後膜で増加することを明らかにした |
今回の研究は、長期増強が発現する分子メカニズムの解明により、学習・記憶が成立する過程、および一部の神経疾患の発症機構の理解を深めることに貢献した形である。
また、今回開発した新実験手法は、シナプス後膜以外の細胞膜の機能解析にも適用できると考えられ、細胞膜分子の動態・機能に着目したさまざまな研究で活用されるものと、研究グループはコメントしている。