群馬大学と理化学研究所(理研)は、マウス生体レベルで酸化ストレスを視覚的に簡便に調べられる方法の開発に成功したことを発表した。群馬大学先端科学研究指導者育成ユニット先端医学・生命科学研究チームの岩脇隆夫講師(理化学研究所 基幹研究所 中野生体膜研究室客員主管研究員兼任)と及川大輔研究員(日本学術振興会特別研究員)らの研究グループによるもので、成果は英科学誌「Scientific Reports」電子版に日本時間1月19日に掲載された。
地球をとりまく大気には約21%の酸素が含まれている。多くの生物は、その酸素を取り込むことで呼吸しており、酸素は生命を維持する上で必要不可欠なものである一方、酸素には有害な一面もある。例えば体内に取り込まれた酸素の一部は、不安定で多くの物質と反応しやすい活性酸素に変化してしまう。この活性酸素は、DNAやタンパク質、脂質などの生体分子を酸化し、それらの機能を奪ってしまうのである。
最近の研究から、このような酸化による生体分子の機能障害(酸化ストレス)は、老化やがん、さらには生活習慣病などのさまざまな疾患をもたらす重要な要因であることがわかってきた。例えば、糖尿病では糖が酸化されタンパク質と結合した異常な糖化タンパク質が増加してしまう。また、動脈硬化を起こした血管では酸化脂質が溜まることにより血管の内径が狭くなり、その結果、血液の流れが悪くなるといわれている。こうした疾患に対する予防・診断、あるいは治療法を開発する上で、生体内の酸化ストレスを評価することが必要になるというわけだ。
これまで、酸化ストレスの評価には、血液や組織のサンプルを用いたマーカー分子の測定が行われてきた。しかし、これらの方法は煩雑な操作が必要で、また結果が判明するまで多くの手間と時間を必要とするという欠点を有していた。
さらに、抽出したサンプルを用いるため、実際の生物レベルで、酸化ストレスが「いつ」、「どこで」生じているかを評価することはできなかった。そこで研究グループでは、これらの問題を克服し、生きているマウスで利用可能、かつ簡便な、新たな酸化ストレスの検出方法の確立を目指し研究を行った。
これまで酸化ストレスとその解消メカニズムについてわかっているのは、次の流れだ。まず酸化ストレス状態に陥ると、それを解消するために抗酸化作用を持つ遺伝子が体内で活性化される。この活性化には、「Nrf2」と呼ばれる分子が「抗酸化応答性エレメント」(ARE:抗酸化作用遺伝子の多くが共通に持つDNA配列)に結合する必要性がある。
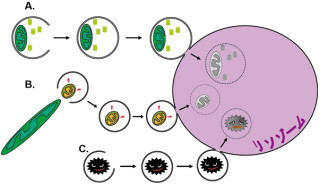
酸化ストレスに曝されていない時、このNrf2は「Keap1」と呼ばれる分子によって恒常的に分解されるので、AREに結合できるNrf2は減り、抗酸化作用を持つ遺伝子の活性化は低く抑えられている仕組みだ。逆に酸化ストレスに曝されている時は、Keap1の機能が抑えられ、Nrf2は分解されずに安定化し、AREに結合できるNrf2を増加させることで、抗酸化作用を持つ遺伝子の活性化を強く促す(画像1)。
|
|
|
画像1。Nrf2による抗酸化遺伝子群の誘導機構。通常、Nrf2はKeap1と結合し、ユビキチン化されることで分解される。しかし、酸化ストレス時にはKeap1が結合しなくなり、Nrf2が安定化。その結果、AREを介して、下流の抗酸化作用遺伝子が誘導される仕組みだ |
研究グループは、このKeap1およびNrf2による酸化ストレス応答反応を上手く活用した人工遺伝子を作成することで、生きているマウスで簡便に酸化ストレスを検出できると考えた。
まずは、ヒト由来のNrf2遺伝子とホタル由来の「ルシフェラーゼ遺伝子」を融合し、それをAREの制御下に置くことで、目的の人工遺伝子を作成。この人工遺伝子を導入した細胞や動物では、酸化ストレスに曝されていない時、人工遺伝子のAREに結合するNrf2が少ないため、融合ルシフェラーゼ遺伝子の活性化は本来の抗酸化作用遺伝子と同様に低く抑えられる。また、Nrf2と融合したルシフェラーゼが合成されたとしても、それはKeap1の働きにより分解される形だ。
逆に酸化ストレスに曝されている時は、人工遺伝子のAREに結合するNrf2が増加し、融合ルシフェラーゼ遺伝子の活性化は本来の抗酸化作用遺伝子と同様に強く促される。もちろん、この状態では融合ルシフェラーゼのKeap1による分解は起こらない。
つまり、この人工遺伝子は酸化ストレスに応じてルシフェラーゼの発現レベルを厳密にコントロールできるというわけだ(画像2)。研究グループは、この人工遺伝子を「Keap1-dependent Oxidative stress Detector, No.48」にちなんで「OKD48」遺伝子と呼び、またOKD48遺伝子を導入したマウスを「OKD48マウス」と呼んでいる。
なお、ルシフェラーゼは生物発光反応を触媒する代表的な酵素として知られている。最近では、遺伝子やタンパク質の発現および活性化レベルを測定するための指標(レポーター)としてさまざまな生命科学研究の場で利用されている形だ。例えば、ルシフェラーゼ遺伝子を導入したがん細胞をマウスに移植し、発光基質「ルシフェリン」を同じマウスに注射すれば、がん細胞の増殖および転移の様子が発光シグナルとして観察できるという具合である。
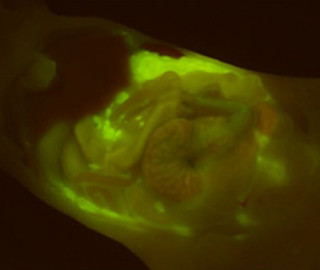
そして、実際にOKD48マウスにルシフェリンを注射したところ、何のストレス処理も施していないものでは、ほとんど発光シグナルを捉えることができなかったが、全身性の酸化ストレスを引き起こすことが知られている薬剤を事前に処理したものでは、体の広い範囲から強い発光シグナルが得られた(画像3)。この結果は、当初の目的である「生きているマウスでの酸化ストレスの簡便な検出方法の確立」の達成を意味しているという。
また、生体イメージング技術の利用により、新たな利点も見出すことが可能だ。OKD48マウスを用いた実験では、マウスを犠牲にすることなく、麻酔下で発光シグナルの観察を行えるため、これにより、従来は不可能だった、同一検体(マウス)を用いた連続的な酸化ストレスの評価も可能になった(画像4)。
さらに、OKD48マウスは実験室で用いられるような強力な人為的酸化ストレスだけでなく、ヒトが通常生活環境下で曝されるような酸化ストレスをも検出可能だ。例えば、紫外線、特にUVA波などである。OKD48マウスに紫外線を照射した場合、非日常的な強度の紫外線照射(30mW/cm2)はもちろん、低緯度地帯で実際に測定される強度の紫外線照射(5mW/cm2)によっても、有意な発光シグナルが検出できたという(画像5)。
|
|
|
画像5。OKD48マウスを用いた紫外線照射に伴う酸化ストレスシグナルの解析。OKD48マウスに非日常的な強度の紫外線(UVA波)を照射したところ、酸化ストレスに伴う強力な発光シグナルを検出(上段)。また、低緯度地帯で実際に測定される日常的な強度の紫外線照射によっても、酸化ストレスに伴う有意な発光シグナルが検出された(下段) |
このことは、OKD48マウスが日常生活で生じるような微弱なレベルの酸化ストレスをも検出可能であることを意味する。今回、研究グループがこのような低レベルの酸化ストレスを上手く検出できたのは、遺伝子レベルでの活性化コントロールとタンパク質レベルでの安定性コントロールを巧みに組み合わせたレポーターシステムを構築できたからにほかならないと考えているとした。
また、今回の研究によって得られた技術の利点を生かし、今後は多くの疾患モデルマウスとOKD48マウスとを交配させ、それにより得られるマウスの詳細な解析を通じ、特定の疾患と酸化ストレスとの関連性が明らかになるとの期待を示す。疾患との関連が明らかになれば、その治療薬開発にもOKD48マウスはその有用性を発揮するかも知れないとのことで、例えば、酸化ストレスとの関連が明らかになった疾患に対し、特定の治療薬がどのくらい酸化ストレスを軽減させるか評価することもできる可能性があるとしている。さらに、紫外線による皮膚の酸化に対して保護作用を示す物質の探索や抗酸化食品の効能評価などが、OKD48マウスを用いることでより効率的に行える可能性もあるという。
なお、研究グループは、別の視点からOKD48マウスの発生・成熟・老化過程を調査することで、生理環境下における酸化ストレス発生機構の解明にもアプローチしていきたいと考えているとしており、今後は、生活習慣病やそれに対する有酸素運動の効果、酸化ストレスとの関係解明を目的として、OKD48マウスを利用していくことも計画しているとしている。