理化学研究所(理研)は2月26日、脳の記憶形成の中枢である「大脳嗅内皮質」-海馬間において、記憶の連結と分離を調節する新たな神経回路を発見したと発表した。
成果は、理研 脳科学総合研究センター(BSI)RIKEN-MIT神経回路遺伝学研究センター利根川研究室の北村貴司研究員、同・Michele Pignatelli(ミケレ・ピグナテーリ)研究員、同・Junghyup Suh(ジャンヒュップ・スー)研究員、同・小原圭吾研究員、同・利根川進センター長(米マサチューセッツ工科大学CNCGディレクター兼任)と、理研 バイオリソースセンターの吉木淳コーディネーター、同・阿部訓也 副センター長らの共同研究チームによるもの。研究の詳細な内容は、日本時間1月23日付けで米科学誌「Science」オンライン版に掲載され、印刷版は日本時間2月21日に掲載された。
ヒトが日々の生活の中でさまざまな出来事に遭遇してそれらを記憶したものを「エピソード記憶」と呼び、それは「何が」、「どこで」、「いつ」、といった物体、空間、時間情報を含む。エピソード記憶の形成には、大脳嗅内皮質-海馬間の神経回路が必須であることはすでに確認されている。
これまでの研究により、大脳嗅内皮質は空間情報や物体情報の情報処理を行う皮質領域で、ここで情報処理された後に海馬に情報が伝達される仕組みがわかってきており、「何が」、「どこで」の2つの情報がどのように脳の中に統合され、記憶されていくかについては比較的理解が進んできた。しかし、「いつ」という時間的情報が、「何が」や「どこで」という情報とどのように脳の中で統合されて記憶されるのかについては、近年ようやく研究が始まったばかりで、まだあまりわかっていない。
その中でわかっていることの1つが、2011年に利根川研究室によって報告された、「いつ」と「何が」をどのように統合するかに関する研究成果だ。研究チームは、数秒から数10秒にわたって時間的に離れた2つの出来事を1つのエピソードとして記憶するためには、大脳嗅内皮質のIII層に位置する神経細胞から海馬の「CA1」領域への直接入力が必須であることが報告されている。大脳嗅内皮質はI~V層の層構造を形成しており、III層に位置する興奮神経細胞は海馬CA1領域の「興奮性神経細胞」へ直接投射を行う構造となっているのだ。
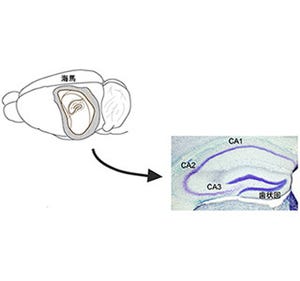
海馬は大脳辺縁系の一部でヒトでは大脳側頭葉の内下部にあり、長期記憶の形成や空間学習に重要な役割を果たしていることで有名だ。海馬は、特徴的な層構造をした細長い形をしており、前述したCA1領域のほかに、「CA2」、「CA3」、「歯状回」の各部位からなる。なお大脳嗅内皮質III層から海馬CA1領域への回路は2種類あり、前述した大脳嗅内皮質III層→CA1という直接経路のほか、「大脳嗅内皮質II層→歯状回→CA3→CA1」で構成される3つのシナプスを介する「トライシナプス性神経回路」も知られている。
「いつ」と「何が」がどのように統合されるのかについて話を元に戻すと、例えば、何も知らない土地で電車を待っている時、突然音が鳴り、鳴り終わった20秒後に電車が到着するとする。この場合、経験によって、音が鳴って、その後しばらくすると電車が来るということが誰でもわかるはずだ。このように時間的に離れた2つの出来事を連結することを「テンポラルアソシエーション」と呼び、エピソード記憶の形成に重要な要素となるという。
しかし、このテンポラルアソシエーションの機能は、動物の「行動利潤」(動物にとって利益となる行動原理)のために、適切に調節される必要がある。例えば、時間的に離れすぎている2つの出来事、もしくは印象が非常に弱い出来事同士などは覚える必要がない。そうしないと、脳の中で記憶の混乱が生じてしまうからだ。しかし、そのような時間的に離れた2つの出来事の連結分離を調節するような仕組みはまったく知られていなかった。
5層ある大脳嗅内皮質内のII層にある神経細胞の多くは、海馬のCA1ではなく、歯状回に軸索を投射していることが知られている。これを実証するため、研究チームは歯状回に「逆行性トレーサー」を注入し、大脳嗅内皮質II層のどの神経細胞が、歯状回に投射しているのかを調査した。
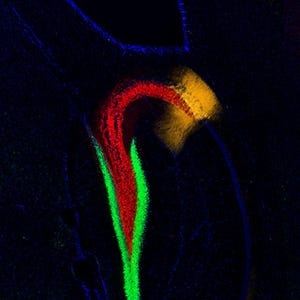
神経細胞の「軸索」内部には「神経終末」より「細胞体」に向かうものと、細胞体より終末に向かうものとの2種類の原形質の流れがある。前者を「逆行性軸索輸送」といい、後者を「順行性軸索輸送」というのだが、今回用いられた逆行性トレーサー「CTB555」は、神経終末より取りこまれ、細胞体に蓄積することから、どの神経細胞が歯状回に軸索を投射しているかどうかがわかるというわけだ。調査の結果、II層内でトレーサーによって染色されない神経細胞群が存在し、それらの神経細胞は球状の細胞集団(クラスター)を形成していることが判明した(画像1)。
研究チームは、この細胞集団に特異的な遺伝子群を調べて同定。この細胞集団は、100個程度の神経細胞からなる球状の細胞集団を形成していることがわかった。約30個の細胞集団が、まるでボールが壁にめり込んでいるかのように、格子状に大脳嗅内皮質II層に内包されていたのである。
研究チームは構造上の特徴からこの神経細胞を「アイランドセル」と命名。また、大脳嗅内皮質II層から歯状回に投射している神経細胞を「オーシャンセル」と命名された。アイランドセルは海馬のCA1領域の限られた層(SL層)に軸索を投射する興奮性神経細胞であり(画像2)、そのSL層に位置する「抑制性神経細胞」とシナプスを作ることで、海馬に対して抑制的に働くことが解明されたのである。
|
|
|
|
画像1(左):大脳嗅内皮質II層におけるアイランドセル(緑色)とオーシャンセル(赤色)。アイランドセルがクラスターを形成していることがわかる。また、アイランドセルの周りにオーシャンセルが位置している。画像2(右):海馬の断面図。アイランドセルの軸索(緑色)が、海馬CA1領域に投射していることがわかる。緑色がアイランドセルの軸索。赤色がCA2領域のマーカー。青が核染色。 |
|
これまでの研究成果から、数秒から数10秒にわたって時間的に離れた2つの出来事を1つのエピソードとして記憶するためには、大脳嗅内皮質III層から海馬への直接入力が必須なのは前述した通り。そこで研究チームは解剖学的知見、生理学的知見を積み重ね、アイランドセルが海馬の抑制性神経細胞を介して、大脳嗅内皮質III層の海馬への入力を抑制することを明らかにした。
このことから、共同研究チームは、「アイランドセルが、時間的に離れた2つの出来事を1つのエピソードとして記憶することを遮断する」という仮説を立てたのである。なお画像3は大脳嗅内皮質III層の海馬への入力を抑制する仕組みのモデル図。アイランドセルの入力(緑)が、CA1の抑制性神経細胞(青)を介して、大脳嗅内皮質III層からのCA1興奮性神経細胞(黒)への入力を、遮断するというわけだ。
続いて、神経回路機能を光と遺伝子操作を使って調べる研究分野で、ミリ秒単位の時間的精度を特徴とする「オプトジェネティクス(光遺伝学)」の技術を用いて、光により人為的にアイランドセルを活性化させたり、抑制したりすることで、テンポラルアソシエーションメモリにどのような影響が出るかが調べられた。
そして、アイランドセルを強く活性化させると、連結すべき2つの出来事が連結できないことが判明したのである。逆に、アイランドセルを抑制すると本来連結すべきでない2つの出来事が1つのエピソードとして記憶されてしまった。つまり、車で例えると、III層からの入力がアクセルとして、アイランドセルからの入力がブレーキとして働き、時間的に離れた出来事同士の連結と分離を調節していることが明らかになったというわけだ。
研究チームは今回、新規の神経回路が発見されただけでなく、時間的に離れた2つの出来事の連結と分離をアイランドセルが制御することを解明した形である。遺伝子の発現にも正と負の調節機構が存在するが、今回、記憶形成にもそうした調節機構が神経回路レベルで存在することが初めて明らかになった。アイランドセルの機能研究は始まったばかりで謎が多く、なぜアイランドセルの細胞集団が格子状に並んでいるのか、グリッドセルとは関係があるのか、なども大変興味深い研究課題としている。
また、記憶に関わる脳内の神経活動や、さまざまな神経系変性疾患、あるいは精神神経疾患のメカニズムの謎を解明していく上で、脳神経回路の正確な地図は欠かせない。現在、脳の正確な地図は部分的にしかでき上がっていないが、脳の地図の完成を目指して、大型の国家プロジェクトが欧州、米国、日本で動き始めている。
今回の研究では、新技術や既存技術を複合的に用いることで、新規の神経回路を明らかにし、新規神経回路の情報を基礎として新たな仮説を考え、そして、時間的に離れた2つの出来事の連結と分離を調節する仕組みが明らかにされた。正確でより完成された脳の地図を効率的に作ることで、記憶の謎や神経系変性疾患・精神神経疾患におけるメカニズムの謎の解明がさらに進展していくと期待できるとしている。