理化学研究所(理研)と国立がん研究センター(NCC)は5月28日、国際がんゲノムコンソーシアム(ICGC)のプロジェクトの一環として、27例の肝臓がんの全ゲノムシーケンス解析を行い、肝臓がんの包括的ゲノム変異を解析したと発表した。
成果は、理研 ゲノム医科学研究センター バイオマーカー探索・開発チームの中川英刀チームリーダーと、NCCがんゲノミクス研究分野の柴田龍弘分野長らの共同研究グループによるもの。それに加え、和歌山県立医科大学、NCC中央病院、和歌山県立医科大学第2外科、国立がん研究センター中央病院、大阪府立成人病センター、東京女子医科大学消化器外科が協力した。
研究の詳細な内容は、日本時間5月28日付けで英科学雑誌「Nature Genetics」オンライン版に(5月27日付け:日本時間5月28日)に掲載され、また雑誌版にも掲載の予定。
肝臓がんは、日本における部位別死亡者数では、男性で3位、女性では6位だ。年間約4万人が肝臓がんと診断され、3万人以上が亡くなっている。特に、日本や中国を含むアジアとアフリカで発症頻度が高く、世界全体の部位別がん死亡率では第3位に挙げられている状況だ。
また、最近では欧米でも増加しており、対策が急がれている。主な原因は、肝炎ウイルスの持続感染であり、世界中の肝臓がんの約75%は、B型肝炎ウイルス(HBV)またはC型肝炎ウイルス(HCV)の感染によるものと推定され、慢性肝炎発症から肝硬変を経ると高頻度で肝臓がんが発生してしまう。
一方、日本では、肝臓がんの約75%がC型肝炎ウイルス、約20%がB型肝炎ウイルスの持続感染が原因と推定されている(国立国際医療研究センター 肝炎情報センター調べ)。そしてウイルスの持続感染者の数は、B型が約100万人、C型が150~200万人いるという推測だ。世界では、慢性B型肝炎患者の数が約3億5000万人、慢性C型肝炎患者は約1億7000万人といわれている(出典:世界肝炎アライアンス)。
肝炎ウイルスは血液を介して感染し、輸血あるいは血液製剤などの医療行為や注射器の共有、性行為などが主な感染原因として挙げられ、社会問題となっている。肝臓がんは、こうしたウイルス肝炎の終末的な形として発生する次第だ。
肝臓がんの治療法には、外科的切除や肝動脈塞栓術など、さまざまな手段がある。2007年米国では、再発性や進行性肝臓がんに対して分子標的薬が使われるようになった。しかし、その予後は悪く、肝臓がんの分子機構の解明による新たな治療法や予防法の開発が強く望まれている状況である。
近年のDNA解読技術の飛躍的な進歩に伴い、「次世代シーケンサー」を用いて、さまざまなタイプのがんや病気のゲノム変異を包括的に解析することが可能になってきた。特に、がんはゲノム変異が蓄積することで発生し進行する「ゲノムの病気」であり、世界中でがんのゲノムシーケンス解析が精力的に行われている。
ちなみに次世代シーケンサーは現行の第2世代で12日間で約6000億個(ヒトゲノム6人分)の塩基配列の解読が可能で、開発中の第3世代は高速の1分子シーケンスも可能であることから、1日で個人のゲノム解読が可能になりつつある。
2008年、最大50種類のがんを選定し、そのゲノム変異の全貌解明とカタログ化を目指し、「国際がんゲノムコンソーシアム(ICGC)」が発足した。日本では、理研と医薬基盤研究所の資金的支援の下、理研と国立がん研究センターなどの研究チームが、主に肝炎ウイルス関連の肝臓がんの全ゲノムシーケンス解析を進めている。
ICGCでは、2012年3月の時点で、47個のがんゲノムに関するプロジェクトが進行中だ。また、3500症例以上の塩基配列の解析データが一般に公開されている。日本の肝臓がんに関するゲノムプロジェクトについては、現在77例の肝臓がんの全塩基配列の解析データをICGCで公開しており、今後さらに解析数を増やしていく予定だ。
共同研究グループは、5つの肝臓がんの専門医療機関と共同で、25人の患者から27例の肝臓がん(B型肝炎関連11例、C型肝炎関連14例、非ウイルス性2例)の検体を収集し、その腫瘍のDNA及び血液からの正常DNAについて、全ゲノム(約30億塩基対)シーケンス解析が行われた。
これは、がん特異的なゲノム変異を網羅的に検索する手法で、そのデータ総量は約7兆個もの配列情報となる。データは、東京大学医科学研究所ヒトゲノム解析センターのスーパーコンピュータを駆使して解析された。その結果、ゲノム変異の数は、1つの腫瘍あたり平均で「ポイント変異」が約1万1000ヵ所、「ゲノム構造異常」が21ヵ所あった。
なおポイント変異とは、ゲノム上の塩基配列の1個~数個が入れ変わったり、抜けたり、挿入されたりする変異のこと。またゲノム構造異常とは、ゲノム上の塩基配列が数100から数1000万塩基にわたって、通常2コピーある配列が1コピーになったり(コピー数異常)、別の染色体部位に位置が変わったり(転座)、方向が入れ替わったり(逆位)など、大きく塩基配列が変化する異常のことである。
27例の腫瘍の内4例は、同じ患者(2例の腫瘍を持つ2人の患者)の肝臓から別々に発生した「多中心性腫瘍」だった。肝臓がんは、肝硬変などの非常に強い発がんの危険のある背景を持つ肝臓のもと、転移ではなく、独立した肝臓がんの腫瘍が同時性または異時性に多発してくる傾向がある。
それら4例の肝臓がんの全塩基配列を比較した結果、まったく異なるゲノム変異であることが判明。これは、同じ肝臓から発生したがんにもかかわらず、異なるゲノム変異を経て発生したものと推定された。
一方で、塩基の置換パターンに着目し、明らかに異なるゲノム異常を示した2例を除いて25例の腫瘍の全ゲノムを比較したところ、肝炎ウイルスの種類や飲酒の習慣などと関連性があることが確認されたのである。
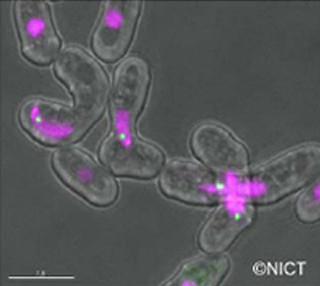
中でも、がんの原因因子が同じと考えられる多中心性腫瘍に由来する4例は極めて類似していた(画像1)。画像1は、塩基置換パターンに基づく、肝臓がんのゲノム全体で見た変異の類似状況をまとめたものである。
収集した27例の内2例は、ほかと明らかに異なるゲノム異常を示していたので事前に排除し、23人の患者からの25例の肝臓がんについて塩基置換パターンについて解析が行われた。
B型肝炎関連の内3例(HB4、HB6、HB7)には、B型肝炎ウイルスの挿入は見られていない。また、同じ患者由来の多中心性腫瘍(青丸)では、塩基が置換されたパターンが酷似している。
|
|
|
画像1。塩基置換パターンに基づく、肝臓がんのゲノム全体で見た変異の類似状況。HB:B型肝炎関連、HC:C型肝炎関連、NBNC:非ウイルス性。HBV:B型肝炎ウイルスゲノムの挿入がある肝臓がん(赤丸)。non-HBV:B型肝炎ウイルスゲノムの挿入がない肝臓がん(緑丸) |
以上から、肝臓がんは非常に多様なゲノム変異を示す一方で、塩基配列の置換パターンは、がんの原因となる肝炎ウイルスや飲酒の有無の影響を受けることも確認された。
次に、27例の肝臓がんでゲノム変異を起こした遺伝子リストを作成し、それらの統計解析を実施。その結果、16例(約60%)の肝臓がんで、「ARID1A」、「ARID1B」、「ARID2」、「MLL」、「MLL3」など「クロマチン制御」に関わる10個の遺伝子の内の1つ以上の遺伝子変異が起きていた(画像2)。
クロマチン制御とは、高等生物のDNAはタンパク質「ヒストン」との複合体を形成しており、その構造をクロマチン構造という。その複合体の形成を通して、RNAへの転写やDNA複製を制御している。DNAのメチル化やヒストンの化学的修飾、ほかにさまざまなタンパク質との複合体形成によってクロマチン構造の開閉が行われる。この現象をDNAの配列情報であるゲノムとの対比で、「エピゲノム」と呼ぶ。
また、細胞株を用いた実験により、それら遺伝子の多くは腫瘍抑制機能を有していることもわかった。
なお、画像2中の「ミスセンス変異」とは、ゲノム変異の結果、タンパク質のアミノ酸配列が変化することをいう。「短い欠失・挿入・ナンセンス変異」は、ゲノム変異の結果、タンパク質が短くなることをいう。「増幅」はゲノム上で本来のコピー数以上に増加すること。「大きな欠失」は、ゲノム配列の大部分が欠損することをいう。
B型肝炎ウイルスは、そのゲノムが肝細胞のゲノムに入りこみ、発がんさせると考えられてきている。今回の11例のB型肝炎関連の肝臓がんを解析すると、4例で「TERT(telomere reverse transcriptase)遺伝子」周辺にB型肝炎ウイルスのゲノム配列が挿入されていることが判明した。
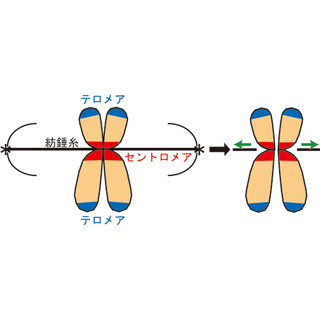
TERT遺伝子は染色体末端の構造を維持し、細胞の不死化に重要な働きをする「テロメラーゼ」(「染色体末端(テロメア)」の反復配列を伸長させる酵素)の活性に関与している。このB型肝炎ウイルスゲノムのTERT周辺への挿入が、B型肝炎関連の肝臓がんの原因の1つだといわれている場所であっても、だ。
ヒトの5番染色体に位置するテロメラーゼのTERT遺伝子は、「逆転写酵素活性」を持つ触媒サブユニットをコードしている。テロメラーゼ活性が低い細胞は、細胞分裂ごとにテロメアの短縮が進み、やがて細胞分裂の停止が起きる。一方、がん細胞、生殖細胞、幹細胞では、高いテロメラーゼの活性が認められ、それらの細胞が分裂を継続できる性質に関与している。
なお研究グループは、がんでクロマチン制御機構の異常が認められたことから、これを標的とした新たな治療法や予防法を開発できる可能性がある、とコメント。
また個々の肝臓がんでは、分子標的治療の標的となるゲノム変異が「リン酸化酵素(キナーゼ)」などで多数見つかった。今後、個々の腫瘍のゲノム変異情報に基づいて、がんの個別化(オーダーメイド)医療を展開できる可能性があるが、そのためにはさらに解析数を増やす必要があると述べている。