東京大学(東大)、東北大学、サヴィッド・セラピューティックスの3者は10月13日、ラクダ科動物の血清中に見出される特殊な抗体を利用した「VHH抗体」を使用した抗体ミメティクス結合薬「AMDC」で、がん細胞へ制がん剤「デュオカルマイシン」を送達し、細胞を殺傷する新しい手法を考案・確立したことを発表した。
同成果は、東大 アイソトープ総合センターの杉山暁助教、東大大学院 薬学系研究科の金井求教授、同・山次健三助教(現・千葉大学大学院 薬学研究院 教授)、同・巽俊文日本学術振興会 特別研究員PD、東北大大学院 薬学研究科の坂田樹理助教、同・徳山英利教授、サヴィッド・セラピューティックスの塚越雅信代表取締役社長らの共同研究チームによるもの。詳細は、タンパク質に関する生化学的および分子生物学的なアプローチを扱う学術誌「Protein Expression and Purification」に掲載された。
従来、抗体に制がん剤を共有結合させた抗体薬物複合体の開発では均質性を求められることから、共有結合での結合部位や結合個数の制御が難しいことや、保存安定性の問題により生じるコストといった課題を抱えていた。こうした背景から研究チームでは、ビタミンB群の1種「ビオチン」と、放線菌由来のタンパク質「ストレプトアビジン」が強い親和性で結合する仕組みを用いた薬物送達用の「Cupid-Psycheシステム」の開発を進めてきたという。
Cupid-PsycheのCupidは、体内で異物と認識されないよう、ストレプトアビジンのアミノ酸を人工的にヒトのアミノ酸に似た形に、そして天然ビオチンが結合できないように改変されたもの。Cupidにがん細胞を認識する抗体ミメティクスを結合して1つの遺伝子とし、大腸菌で融合タンパク質として製造することで、狙ったがん細胞へ結合する能力を持たせることが可能だという。
一方のPsycheは、天然ビオチン代替えとして設計されたもので、Cupidとの非共有結合による強い結合を形成する。リンカーを介して薬剤を結合でき、狙ったがん細胞へ薬剤を送達することが可能だという。scFv抗体やアフィボディー(抗体ミメティクスの1つ)をCupidと融合させたタンパク質を大腸菌で製造する方法が確立されており、そこにペイロード(薬剤)として光増感剤、ラジオアイソトープも使用したAMDCによるがん細胞への薬物送達技術の開発が進められてきた。
-
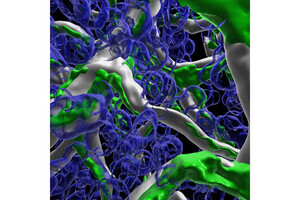
Cupid-Psycheシステムの概略。Cupid-Psycheシステムでは、Cupidに融合するがん細胞を認識するタンパク質の選択性がある。VHH抗体やアフィボディーなどから、転移、再発し性質が変化してしまったがん細胞を認識できるものを選択し、迅速に製造可能だ。また、薬剤耐性を獲得したがん細胞に対し、効果のある薬剤を選択できるようPsyche-薬剤も多種類を迅速に製造できるという。Cupid-Psycheは非共有結合のため、混ぜるだけで抗体ミメティクス薬物結合薬を調製することが可能 (出所:東北大プレスリリースPDF)
今回の研究では、VHH抗体とCupidを融合させたタンパク質をデザインし、大腸菌の封入体から製造する技術を確立することにしたとするほか、単独では高い副作用のデュオカルマイシンを効果的に使用するため、Psyche-デュオカルマイシンのデザインと合成も同時に行い、それらのAMDCの調製を実施し、マウスでの治療効果の検証が行われた。
具体的には、乳がんや消化器がんで発現が多い「HER2」をターゲットにしたVHH抗体が用いられたとする。VHH抗体は細胞表面抗原に結合後、細胞内に内在化される特徴を持っており、HER2を認識するVHH抗体とCupidの融合タンパク質(抗HER2VHH-Cupid)を大腸菌の封入体として発現させ、変性・巻き戻しおよび4量体タンパク質の最終精製法の至適化が行われた。一方、ペイロードであるPsyche-デュオカルマイシンは、細胞内取り込み後、細胞内のカテプシンB酵素で切断されPsycheから遊離可能なリンカーがデザインされ、Psycheとデュオカルマイシンをつないだ化合物が合成された。
その結果、4量体タンパクとして精製された抗HER2VHH-CupidとPsyche-デュオカルマイシンから作られたAMDCは、ヒト乳がん細胞に対し濃度依存的な細胞傷害性を示すことが確認され、遊離したデュオカルマイシンが速やかに細胞核内へ移行し、DNAをアルキル化により切断できることが、細胞実験でわかったという。
-
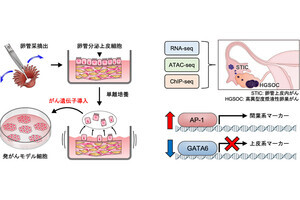
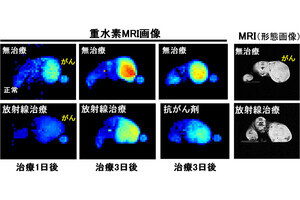
デュオカルマイシンの細胞殺傷に必須な細胞内在化。今回の研究では、乳がん細胞表面にある抗HER2VHHが使用され、がん細胞への結合の後、細胞内への内在化が促進されている。内在化すると、細胞内酵素のカテプシンBにより、Psycheとデュオカルマイシンをつないでいるリンカーが切断され、デュオカルマイシン(Duo-val)が遊離する。遊離したDuo-valは細胞核内のDNAと結合して切断するので、その細胞は死んでしまう。副作用を抑え、治療効果を高めるためには、このような複雑な仕組みが必要とした (出所:東北大プレスリリースPDF)
また、ヒト乳がん細胞が移植されたマウスでの治療効果の検証より、16日間という短い間隔で2回投与された2匹のマウスは、緩やかな腫瘍縮小が観察されたほか、治療開始から約80日後の解析では、生存しているがん細胞は残っていないことが病理学的に確認されたとのことで、研究チームではこれらの結果を踏まえ、AMDCが有効な治療効果をもたらすことを示すものであるといえると説明している。
-
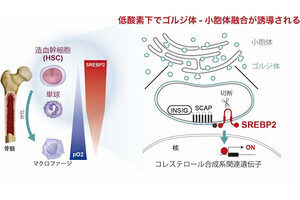
抗体ミメティクス制がん剤結合薬のマウスでの治療効果。ヒト乳がんKPL-4細胞を移植したモデルマウスを用いた実験の結果。(上段)未処理マウス(5匹)の腫瘍サイズの平均値の変化。細胞移植から48日目以降も腫瘍が大きくなり続けた。(下段)抗体ミメティクス制がん剤結合薬が投与された2匹のマウスの腫瘍サイズの変化。細胞移植から48日目に1回目の薬剤投与が、その16日後に2回目の投与が行われた。1回目の投与後に早い腫瘍縮小が見られた後、2回目の投与後も緩やかな腫瘍縮小が観察された。2回目投与68日後にはがん細胞が消失していることが病理解剖により確認された (出所:東大Webサイト)
なお今回、細胞内在化が早いVHH抗体と高活性の制がん剤を非共有結合させたAMDCにより、目的のがん細胞まで薬剤を送達でき、がんの治療効果をもたらすことに成功したことから、研究チームでは今回の成果は、Cupid-PsycheシステムによるAMDCを開発していく上での足掛かりとなり、副作用を抑え治療効果の高いがん治療薬の開発を促進することが期待されるとしている。