東京大学(東大)、国立精神・神経医療研究センター(NCNP)、東京農工大学(農工大)の3者は3月1日、心的外傷後ストレス障害(PTSD)の分子機構を発見したことを共同で発表した。
同成果は、東大大学院 農学生命科学研究科の喜田聡教授、NCNP 精神保健研究所の金吉晴所長、同・堀弘明室長、農工大 生命科学部の福島穂高准教授らの国際共同研究チームによるもの。詳細は、英科学誌「Nature」系の分子精神医学を扱う学術誌「Molecular Psychiatry」に掲載された。
PTSDは生死に関わるような大事故、災害、暴力、戦争などのトラウマ体験の記憶を原因とする精神疾患で、その主症状は、同体験の記憶が現実であるかのように自発的に繰り返し思い出される、「フラッシュバック」などの再体験症状。しかし同症状を含め、PTSDの機構は不明な点が多いという。世界的には、PTSD患者の大規模なゲノム解析が行われ、関連遺伝子候補群も同定されているが、それらによるPTSDの発症と症状の機構は未解明のままであるとのこと。
-
今回の研究におけるPTSD再体験症状の分子機構。(A)先行研究の成果と、今回の研究成果によるトラウマ記憶想起の分子機構。(B)cAMP経路の過活性化によるPTSD再体験症状の発症(出所:東大Webサイト)
トラウマ記憶の1つに「恐怖記憶」があるが、これはヒトを含めた動物に普遍的に存在している。そのため、げっ歯類を用いてその制御の研究が進められており、世界的にもげっ歯類の恐怖記憶をPTSDモデルとして、PTSDの機構の理解とその治療方法の開発への応用が試みられている。
研究チームは先行研究において、マウスを用いた「環状アデノシン一リン酸(cAMP)情報伝達経路」(以下、cAMP経路)が記憶の思い出し(想起)を正に制御することを報告していた。そこで今回の研究では、それに基づき、同経路の活性化はPTSDにおける再体験症状にも関与する可能性を考察し、研究を進めることにしたという。
-
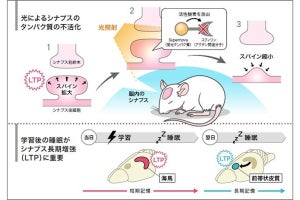
光遺伝学を用いたマウス海馬におけるcAMP量増加後のトラウマ記憶増強。マウス海馬にbPACを発現させて青色光によってcAMP量を増加させると、トラウマ記憶が強く想起され、その後の再固定化によって同記憶が増強された(出所:東大Webサイト)
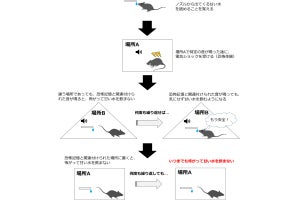
トラウマ(恐怖)記憶とcAMP経路との関連性を検証するため、人為的にマウスの海馬のcAMP量を操作することで、恐怖記憶に及ぼす影響が解析された。cAMP量を増加させた場合には恐怖記憶がより強く思い出され、その後に恐怖記憶がより強固になり、再体験症状様の行動が観察されたという。その一方で、海馬のcAMP量を低下させた場合には、恐怖記憶の思い出しが抑制され、さらに、その後の恐怖記憶が減弱することが明らかにされた。これらは、同経路の活性化により、トラウマ記憶の想起と再固定化が促進され、同記憶が強化されることを示唆するものとする。
さらに、PTSD患者の末梢血とマウスPTSDモデルにおける恐怖記憶想起時の海馬におけるmRNA発現の網羅的な比較を実施。すると、両方で顕著に発現低下している遺伝子として、「ホスホジエステラーゼ4B」(PDE4B)が発見されたという。PDE4Bは細胞内の主要セカンドメッセンジャーであるcAMPの分解酵素であるため、その発現低下はcAMP経路の活性化を導くとする。なお、PTSD患者では再体験症状が重篤であるほどPDE4Bの発現が低く、再体験症状と末梢血PDE4B mRNAの間に負の相関があることが確認された。つまり、再体験症状と同経路の過活性化が関与することが示唆されたのである。
また、PTSD患者の末梢血のPDE4B遺伝子のDNA修飾(メチル化)もそのmRNA発現量に相関することが示されたという。そのことから、PTSD患者の末梢血におけるPDE4Bの発現低下は一過的なものではなく、その発現が継続して低下していることが強く示唆されたとする。ちなみにマウスPTSDモデルを用いた解析では、恐怖記憶を想起させた後に、海馬ばかりではなく、末梢血においてもPDE4B mRNAの発現量の低下があり、PTSD患者とマウスPTSDモデルとの相同性が示されたとした。以上の結果は、PTSDの再体験症状とcAMP経路の活性化が関連することを強く示唆するものとした。
-
マウスPTSDモデルにおけるPDE4B発現量の低下。マウスPTSDモデルでは、トラウマ記憶想起後に記憶中枢である海馬のみならず、末梢血においてもPDE4B mRNAの発現量が低下する(出所:東大Webサイト)
-
PTSD患者とマウスPTSDモデルにおけるPDE4B発現の相同性。再体験症状を示すPTSD患者とトラウマ記憶想起後のマウスPTSDモデルでは、末梢血におけるPDE4B mRNAが発現低下を示し、マウスモデルでは海馬でもその発現量が低下していることが確認された(出所:東大Webサイト)
今回の成果から、同経路の不活性化を導くことでPTSDの新規治療薬の開発につながる可能性が示唆された。実際には、今回の研究で用いられたNB001はcAMP量を抑制する薬剤であり、PTSD治療薬の候補となっている。同経路を標的としてPTSDの発症と病態の理解と治療方法開発を進める道が開け、今後、PTSD治療薬の開発が加速することが期待されるとしている。