ライフサイエンス・イノベーション・ネットワーク・ジャパン(LINK-J)は7月4日、LINK-Jシンポジウム「創薬のフロンティア2023」を東京都内で開催した。本稿では同イベントから、プリファードネットワークスの石谷隆一郎氏が語った、深層学習技術を用いた創薬への応用に関する講演をお届けする。
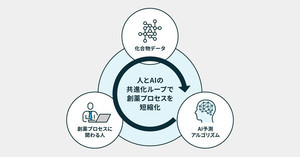
深層学習はディープラーニングとも呼ばれ、何層ものニューラルネットワークを用いる機械学習の手法の一つだ。現在のAI技術を支える主要な手法であり、標的の探索や新規薬剤候補の生成から、臨床データの解析、RWD(リアルワールドデータ)の解析など、幅広い活用方法が期待できる。自然言語処理にも深層学習は使われているため、安全性情報などの処理にも応用可能だ。石谷氏の講演では、特に新規薬剤候補の生成と薬剤候補の最適化にトピックの焦点が当てられた。
創薬研究におけるAIの有効性
従来の創薬研究においては、DMTAサイクル(Design:設計、Make:合成、Test:評価、Analyze:分析の一連のサイクル)が主な手段だ。しかし、この手法は化合物をデザインしてから合成する過程を経るため、多くの時間とコストを要する課題があった。
また、研究者の過去の経験や既知の化合物の情報に左右されるため、既知のリガンド(受容体と結合して作用する化合物)が起点となり、これまでと大きく異なる新規の化合物の発見が困難でもあった。
このうち、デザインの段階に対して、深層学習に代表されるAI技術を用いることで、個別のプロジェクトやターゲットに適した化合物のプロファイルを指定して、アルゴリズムによって化合物を生成できるようになる。
既知の化合物の構造に依存せずに、物性と薬効など複数の数値目標を達成する有望な化合物を発見できる可能性があるのも、AIの利点だ。計算によって化合物の設計と解析を繰り返すため、実際に合成し試験する過程を最小限に抑えられ、コストの削減にもつながる。
昨今はテキスト生成AIの「ChatGPT」や、画像生成AIの「Stable Diffusion」などが話題となっているが、創薬の領域でも生成AIは有用なのだという。深層学習を用いた生成AIは条件付けした出力を生成できる特徴を持つ。
例えば、画像生成AIに「馬に乗っている宇宙飛行士」と指示を出すように、化合物モデルを生成するAIに対して「ある酵素活性の阻害能を持つ水溶性の化合物」と指示を出すことで、目的とする性質を持った薬の候補を生成する仕組みだ。
AIを軸とする化合物開発の要素技術
以前は、化合物中に特定の部分構造が含まれるか否かをバイナリデータ(0 or 1)で示した「Fingerprint」が使われていたが、この手法は分子の情報から分子の構造を表現できない不可逆的な課題を抱えていた。
近年の深層学習の発展に伴い、化合物の情報を文字列として扱う「SMILES」や、グラフ構造として扱う「Graph」など、分子と分子表現を可逆的に記述できるようになったことで、創薬研究への生成AIの応用が進んだようだ。
VAE(Variational Auto-Encoder:変分オートエンコーダ)やGAN(Generative Adversarial Networks:敵対的生成ネットワーク)、RNN(Recurrent Neural Network:回帰型ニューラルネットワーク)など、自然言語や画像の学習に用いられる主要な手法も化合物の生成に応用されている。
深層学習を用いた分子設計は、既知の化合物に依存せずに新規の化合物の発見が期待できる手法だ。従来の手法と比較しても、予測活性値や物性、既知の化合物との類似性など、複数の条件を考慮したプロファイルの設定が可能な利点を持つ。
しかしその反面、柔軟であるが故に何でもできてしまうため、まずはプロジェクトごとに目的とする化合物のプロファイルを議論して明確にしておく必要があるとのことだ。
「『良い化合物とは何か?』を、深層学習(ドライ)の研究者と実験(ウェット)の研究者が密に議論しておく必要がある」と石谷氏は指摘していた。
すでに、AI創薬によって生み出された化合物が前臨床段階や臨床開発候補まで到達する例も出始めている。AIを用いた今後の創薬の加速に期待だ。