奈良先端科学技術大学院大学(NAIST)は3月17日、生体内で浮遊する細胞が、周囲を取り巻く繊維状タンパク質のコラーゲンなどといった細胞外基質に接着し、これを足掛かりに移動する仕組みについて、超極細の繊維(ナノファイバー)を使い、細胞が1本の繊維状タンパク質だけに接着した場合の移動の振る舞いを明らかにしたことを発表した。
同成果は、NAIST 先端科学技術研究科 バイオサイエンス領域の末次志郎教授、米・バージニア工科大学のアムリンダー・ナイン准教授、イスラエル・ワイズマン科学研究所のニル・ガブ教授、理化学研究所(理研)の清末優子チームリーダーらの国際共同研究チームによるもの。詳細は、物理、化学、医学、生命科学、工学などの基礎から応用までを扱う学際的なオープンアクセスジャーナル「Advanced Science」に掲載された。
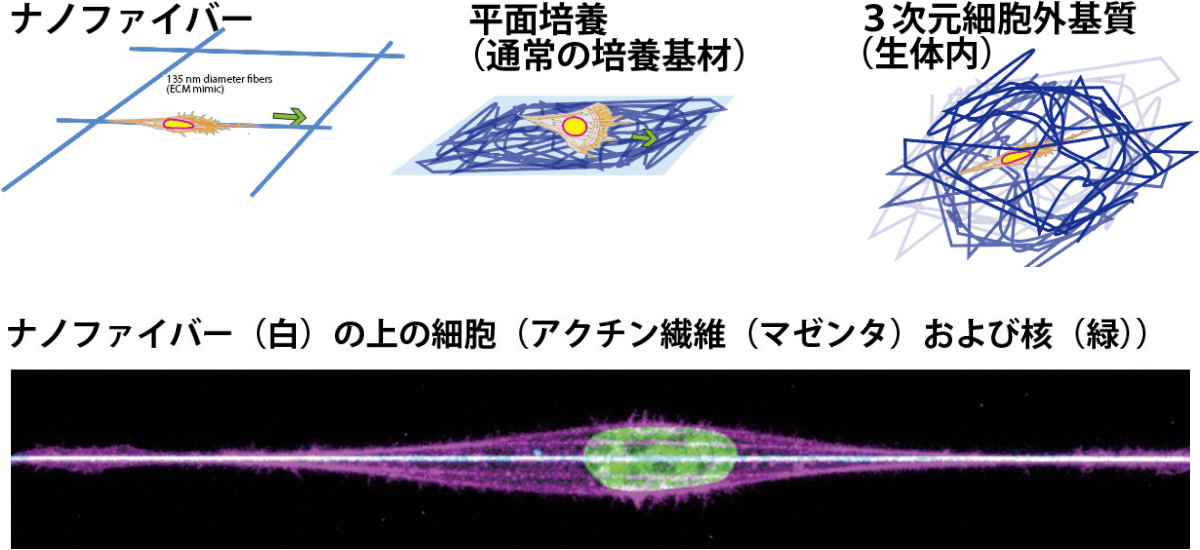
細胞移動の機構は、がん細胞の転移や発生に伴う細胞の再配置など、生命の根源的な現象の解明につながるとされる。細胞の移動様式として、生体内では3次元の細胞外基質中が大半を占めると考えられている。しかしコラーゲンなどは、繊維状タンパク質が複雑に絡み合った形状であるため、その最小単位である1本の繊維での細胞の移動がどうなっているのかは明らかではなかったとする。
一方、高精細な顕微鏡観察に基づく細胞移動機構の解明は、観察に適したカバーガラスなどの薄いガラス板状に細胞外基質を塗布することで細胞を接着させ、観察を行うことで得られてきた。そのため、1本の細胞外基質繊維で細胞移動に十分であるか、またその分子機構は、これまで知られている2次元および3次元の細胞の移動様式と共通点があるかどうかについても明らかではなかったという。
細胞突起はこれまでに、細胞の移動のための構造であると考えられていた。そうした中、細胞の脂質膜(生体膜)の微細な形態形成を担うタンパク質モジュール「BARドメイン」の研究を行ってきたのが、NAISTの末次教授の研究チームだ。タンパク質モジュールとは機能を持ったタンパク質の1部分を指し、BARドメインは、タンパク質が生体膜上で集まりブロックのような形態を作ることで、生体膜の形態を制御するタンパク質ドメインである。
また同研究チームは、細胞突起が、BARドメインの一種である「I-BARドメイン」による細胞膜の変形によっても生じることも明らかにしていた。これらの変形した細胞膜は、I-BARタンパク質と協調して制御される細胞内繊維「アクチン細胞骨格」によって強度を付与され、運動装置として完成すると考えられてきたのである。