九州大学(九大)は、稚魚までは体が透明で脳の観察をしやすいゼブラフィッシュを使って「脳のサイズを制御する分子経路」を新たに発見したと発表した。成果は、九大生体防御医学研究所の石谷太 准教授らの研究グループによるもので、詳細な研究内容は欧州分子生物学機構誌「EMBO Journal」オンライン版に英国時間2月28日に掲載された。
生物の脳は、その元となる神経幹細胞・神経前駆細胞が適切に増殖することにより、正しいサイズで形成される。これまでの研究で、細胞外タンパク質「Wnt(ウィント)」が脳の形成過程において、神経幹細胞・神経前駆細胞の増殖を促進することが確認済みだ。
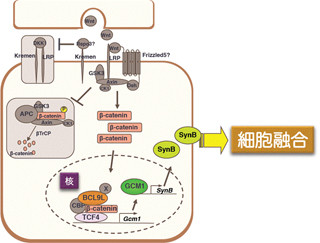
Wntは、分子経路「Wntシグナル経路」(画像1)を介して細胞外から細胞核内の遺伝子に"細胞増殖を促す指令"を伝達する。しかし、Wntシグナル経路において指令の伝達を担う"役者"の全貌は未だに明らかになっていない。
現在のところわかっているのは、「Wnt受容体」、「Dvl」、「βカテニン」、「LEF1」といったタンパク質群が指令伝達において中心的な役割を担っているということだ。
細胞がWntを受容すると、細胞中のDvlが活性化し、活性化したDvlはβカテニンとLEF1の複合体形成を促す。そして、βカテニン-LEF1複合体は細胞増殖を促す指令を遺伝子に直接伝えるという流れである(画像1)。
石谷准教授らは、13年前にLEF1をリン酸化(リン酸を付与)する酵素として「Nemo-like kinase(NLK)」を発見。しかしながら、NLKによるLEF1のリン酸化が生体内におけるWntシグナル経路にどのような影響を及ぼすのかについては不明だった。
NLKは形成過程の脳に多く存在しており、このことから脳の形成過程におけるWntシグナル経路による神経幹細胞・神経前駆細胞の増殖制御に関わる可能性が期待されていたのである。
現在までに、NLK遺伝子を破壊したマウスなどが作成されているが、マウスの脳の形成過程をWntシグナル経路の活動と関連づけて解析するのが困難であったため、脳形成におけるNLKとWntシグナル経路の関係は未解明のままだった。
石谷准教授らは、脳形成過程とWntシグナル経路の活動とNLKの機能の三者を関連づけて解析するために、小型魚類ゼブラフィッシュを使用。ゼブラフィッシュは体外で成長し、受精卵から稚魚に至るまで体が透明なため、生きたまま脳の形成過程を観察することが可能だ。
今回の研究では特に、"Wntシグナル経路(活性化したLEF1)による遺伝子への指令伝達"を"蛍光タンパク質GFPの緑色蛍光"に変換するシステムを組み込んだWntシグナル可視化ゼブラフィッシュが用いられた。
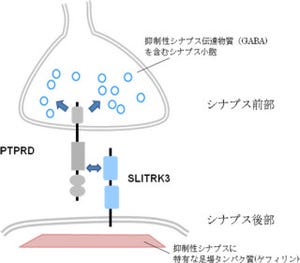
画像2の写真に示したように、この可視化ゼブラフィッシュは、形成過程の中脳において緑色蛍光を発する。このことは、Wntシグナル経路が形成過程の中脳において活動していることを示すものだ。
石谷准教授らは、NLKの機能を阻害するとこの中脳における緑色蛍光が弱くなることを発見した(画像2・下段)。このことから、中脳においてWntシグナル経路が活動するにはNLKが必要であることというわけだ。
また、NLKを機能阻害するとWntシグナル経路の活動低下により中脳の神経前駆細胞の増殖が低下し、その結果として中脳から形成される脳組織の「視蓋」(画像2、右端の写真の点線で囲んだ部分)が小さくなってしまうことがわかった。
さらに、NLKによってリン酸化される分子であるLEF1を機能阻害してもNLKと同様の異常が中脳領域において引き起こされることや、NLKを機能阻害したゼブラフィッシュではLEF1のリン酸化が消失すること(画像2)、NLK機能阻害ゼブラフィッシュに擬似的にリン酸化状態にした変異型LEF1を導入すると、視蓋が縮小する異常が回復することも発見した。
これらの結果から、NLKが中脳においてLEF1をリン酸化することによりWntシグナル経路の活動を促進し、これにより神経前駆細胞の増殖を促して、正常なサイズの中脳視蓋の形成に貢献することが判明したのである(画像2)。
続いて、石谷准教授らは、哺乳類由来の細胞株を用いた解析を行い、ゼブラフィッシュだけでなく、哺乳類の神経前駆細胞においてもNLKがWntシグナル経路の指令伝達に必須であることを確認した。
次に、Wntシグナル経路において、NLKはどのように指令伝達に関わるのかが調べられた。ゼブラフィッシュと哺乳類細胞株を用いた詳細な解析の結果、神経前駆細胞におけるWntシグナル経路は以下の機序で遺伝子に指令を伝達することがわかったのである。
まず、Wntを受容していない神経前駆細胞では、タンパク質「HDAC1」がLEF1と強固に結合し、LEF1の働きを強く抑制している(画像3・左)。一方、神経前駆細胞がWntを受容すると、活性化したDvlが"βカテニンとLEF1の結合"と"NLKによるLEF1のリン酸化"の双方を促す。そして、LEF1のリン酸化の結果としてHDAC1がLEF1から分離され、βカテニン-LEF1複合体が活性化し、遺伝子に指令を伝達するというわけだ。
こうして、神経前駆細胞の増殖を促進して脳のサイズを制御する新しい分子経路"NLK依存的Wntシグナル経路"が明らかになったのである。
なお、Wntは脳だけでなく肺や腎臓、肝臓などさまざまな臓器のサイズも制御していることが確認済みだ。また、Wntシグナル経路の過剰な活動は大腸がん、肝臓がん、脳腫瘍などの発症の一因となっていることがわかっており、また「試験管内で肝臓がん細胞におけるNLKの機能を阻害するとがん細胞の増殖力が低下する」という、"がん"、"Wntシグナル"、"NLK"の三者の関係を示唆する報告も上がっている。
石谷准教授は、今後は、脳以外の臓器の形成とがん発症にも注目して解析を行っていくことが重要と考えられるという。また、"将来的にNLKによるLEF1リン酸化を操る薬"などの開発が進めば、ヒト体内から取り出した神経前駆細胞あるいは神経幹細胞を増やせる可能性があり、脳組織の障害や神経変性疾患に対して、幹細胞を使う新たな治療法に道を拓く可能性があるとしている。