理化学研究所(理研)の研究グループは、遺伝子に付けられた「使用禁止マーク」を外すタンパク質「UTX」の立体構造を解明し、UTXが他の機能を意味するマークと厳密に区別して、「使用禁止マーク」だけを外す仕組みを解明した。同成果は、理研生命分子システム基盤研究領域の横山茂之領域長と仙石徹研究員によるもので、米国の科学雑誌「Genes & Development」(11月1日号)に掲載されるに先立ち、オンライン版にて掲載された。
ヒトを含む多細胞生物は、異なった働きを持つ多くの細胞で構成されているが、個々の細胞はほぼ共通のDNA配列を持っていながら、異なった種類の遺伝子をオンにすることで異なった機能を発揮している。これらの生物には、DNA塩基配列そのものは変化させずに、遺伝子やタンパク質にさまざまな化学的マークをつけることでその働きを制御する仕組みが備わっており、「エピジェネティクス」と呼ばれる学問分野として注目を集めている。化学的マークには、DNAを構成する4つの塩基(アデニン、グアニン、シトシン、チミン)のうち、シトシン塩基に付けられるメチル基(メチル化)などDNAに直接付けられるものや、DNAが密接に巻きついた「ヒストン」と呼ばれるタンパク質に付けられるものなど、さまざまな種類が存在していることが知られている。
例えば、ヒストンH3はいくつかの場所でメチル化され、それぞれ違った機能を発揮しるが、27番目のリジン残基(リジン27)がメチル化すると、「この遺伝子を働かせてはいけない」という「使用禁止マーク」になる。ES細胞やiPS細胞などの多能性幹細胞では、多くの遺伝子がこの使用禁止マーク、つまりリジン27がメチル化されているため、遺伝子はオフの状態になっている。
ただし細胞が分化を始めると、適切な時期に、決まった細胞の、働くべき遺伝子が巻きついたヒストンH3のリジン27のメチル基が外れ、その結果、遺伝子はオンになり、細胞が決まった機能を発揮する仕組みとなっている。。ゲノム上における使用禁止マークのパターンは厳密に制御されており、一度異常が起こって制御が不能になると、発生異常や細胞のがん化が引き起こされることとなる。

|
|
図1 UTXは遺伝子をオフ状態からオン状態にする。メチル化されたヒストンH3のリジン27は遺伝子の使用禁止マークとして働く。UTXは「リジン27のメチル基を外す機能」を持っており、遺伝子が特定の細胞で適切な時期に働くように作用する |
このため、他の役割を持つマークが誤って外れると、細胞にとって悪影響が出てしまうが、マークの周辺を見ただけではそれが外すべきマークかどうか区別することが困難な場合があった。これまでの研究で、リジン27のメチル基を外してその遺伝子をオンにする働きを持つタンパク質「UTX」の存在は明らかにされていたが、使用禁止マークを他の機能を意味するマークと区別できる仕組みはまったく分かっておらず、謎のままであった。
今回、研究グループは、UTXがリジン27を含むヒストンH3断片と結合した状態の結晶を作製し、大型放射光施設SPring-8のBL41XUビームラインを用いてX線結晶構造解析を行った。その結果、UTXが触媒ドメインやUTX固有のドメインを持っていることが明らかとなった。
触媒ドメインは、メチル基をリジン27から外す化学反応を引き起こすドメインで、その立体構造はこれまでに報告されていた別のマークを外すタンパク質とよく似ていたという。一方、固有ドメインは、これまでに構造解析されたどのタンパク質とも似つかないものであることが確認された。

|
|
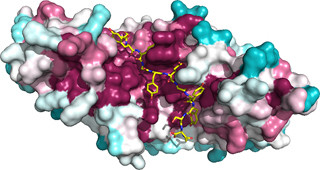
図2 UTXとヒストンH3が結合した立体構造(90度回転した2方向の図)。左は赤点線で示した2カ所でUTXとヒストンH3が結合している。右はメチル化されたリジン27(赤点線)が触媒ドメインに結合しており、ここでメチル基を外す反応が進行する構造 |
ヒストンH3は、リジン27を含んだ25番目から32番目までのアミノ酸配列が触媒ドメインと結合しており、メチル化されたリジン27は触媒ドメインの中央の穴の奥深くに埋め込まれ、ここでメチル基を外す反応が進行する一方、固有ドメインは、少し離れた17番目から22番目までのアミノ酸配列と結合していることも確認された。

|
|
図3 UTXとヒストンH3との結合の模式図。触媒ドメイン(青)と固有ドメイン(緑)はともに、「鍵と鍵穴」の関係のようにヒストンH3(黄)とフィットする形をしている。ヘリカルドメイン(ピンク)と呼ばれるドメインは触媒ドメインと固有ドメインをつなげている |
次に、解析した立体構造を基に生化学的解析を行い、ヒストンH3との結合に重要な場所に変異を導入したUTXを作製しその活性を調べたところ、触媒ドメインの変異だけでなく、固有ドメインの変異もメチル基を外す活性を低下させることが分かった。また同様に、触媒ドメインや固有ドメインと結合する部分に変異を導入したヒストンH3でも、UTXがメチル基を外す活性が低下することも見いだされた。これはすなわち、両方のドメインによる結合が、UTXのメチル基を外す活性に重要であることを意味すると研究グループでは説明している。
タンパク質が特定の分子を区別して働く仕組みは、よく「鍵と鍵穴」の例えで説明される。タンパク質は決まった形(鍵穴)を持っており、それが働く相手(鍵)の形とぴったりフィットするときにだけ働くと考えられている。今回の成果は、UTXは触媒ドメインと固有ドメインという2つの鍵穴を持つことで、双方の鍵がそろったときに初めてリジン27を区別し、メチル基を外すという仕組みを解明したもので、この結果は、UTXが細胞分化プロセスを制御する仕組みの詳細な解明につながるほか、立体構造が明らかになったことで、UTXの阻害剤をデザインする試みも可能になり、今後は、そうした阻害剤を細胞分化の制御ツールとして活用することが可能になることが期待されるほか、iPS細胞などの多能性幹細胞の利用を通じた再生医学研究への貢献にも期待できると研究グループでは説明している。