慶應義塾大学(慶応大)は、大脳皮質の形成時期に見られる神経細胞の特徴的な動きの制御メカニズムを明らかにしたと発表した。
成果は、同大 医学部解剖学教室の仲嶋一範教授、田畑秀典専任講師、吉永怜史医師らの研究グループによるもの。研究の詳細な内容は、米国東部時間8月22日発行の米国神経科学雑誌「The Journal of Neuroscience」に掲載される予定だ。
ヒトの脳において最も大きな容積を占め、記憶や学習などの高度な機能を担う大脳皮質は、脳表面近くで神経細胞が層状に集まる「灰白質」と、その深部で神経細胞から伸びる「軸索」が束となって走る「白質」から構成される。大脳皮質を構成する神経細胞は、脳の深部で誕生した後、脳表層側へと移動して整然と配置され、全体として整然とした層構造を形成することが知られている。
発達過程において神経細胞が誕生する脳の深部とは、脳脊髄液で満たされている脳内の空間である「脳室」に面した部位だ。そして誕生後、神経細胞は大脳皮質のそれぞれの目的地に正確に移動して配置されることによって機能する。
研究グループによる近年の研究で、大脳皮質神経細胞の約8割を占める「興奮性神経細胞」は、脳室近くで誕生した後にすぐには移動を開始せず、多数の突起を活発に伸縮させる「多極性細胞」となって、生まれた場所の近くに長時間さまようように留まることがわかった(多極性移動)。
やがて、突起の一本が神経細胞同士を連絡する軸索になり、脳表面に平行な特定の方向(横方向)に長く伸びるようになる。またこれと前後して、細胞本体は脳表面側に向かう太い突起を持つ形態に変化し、比較的速い速度で脳表面(縦方向)への移動を開始する(画像1)。
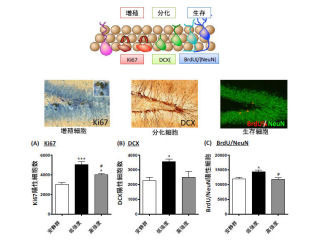
画像1は、誕生した興奮性神経細胞が多極性細胞となり、移動する様子を表した模式図。脳室面近くで誕生して移動初期段階で多極性細胞となった興奮性神経細胞は、活発な多数の突起の伸縮を行う。
やがて、多極性細胞は軸索を横方向(脳表面に平行な方向)に伸ばし、それと前後して、太い先導突起を脳表面側に向けて伸ばして、放射状線維という足場を使って放射状方向(縦方向)に速い移動を開始するのである。
これらのことから、多極性細胞の突起の伸縮は、周囲の環境を探りながら、軸索を伸ばす方向や細胞が移動すべき方向を決定することに役立っているのではないかと、研究グループは考えたという。
つまり、細胞は細胞の外から「こちらに動きなさい」というシグナルをただ待っているという「指示待ち族」ではなく、積極的に周囲の微細な環境の変化を探りにいく「主体的な存在」であって、この特徴的かつ積極的な動きこそが、安定かつ精緻な細胞移動を可能にしているのではないかというものだ。
細胞移動の障害と滑脳症などの比較的稀な脳形成障害との関連は以前から指摘されているが、近年ではさらに軽微な細胞移動・軸索伸長の異常と発達障害やてんかん、統合失調症などの精神・神経疾患との関連が指摘され、注目が高まっている。しかしながら、多極性細胞の特徴的な突起伸縮がどのような仕組みで起きているのかは、ほぼ未解明のまま残されていた。
伸びつつある軸索の先端には、「成長円錐」と呼ばれる手のひらの様な構造がある。軸索が伸張する過程では、この成長円錐が活発に運動しながら周囲の環境を感知し、軸索を正しい方向に導いていく。成長円錐の運動は、「アクチン線維」の重合と脱重合によって調節されている。
今回の研究では、まず多極性細胞の突起伸縮運動が成長円錐の運動と類似していることを明らかにし、さらに多極性細胞の突起伸縮にもアクチン線維の重合/脱重合とそれを制御する分子群が働いている可能性について検討が行われた。
成長円錐は数分の時間内で突起の伸張や退縮を行っていることは、以前から知られている。そこでまず、多極性細胞の運動が2分間隔で観察された。その結果、多極性細胞の突起は成長円錐と同様に分単位で刻々と変化しており、その突起の形態も成長円錐のものと類似していることが判明したのである。
また、多極性細胞の突起はアクチン線維を豊富に含んでいることも確認された。そこで、成長円錐においてアクチン線維の重合/脱重合を制御してその運動に関わる「ラメリポディン(Lpd)」に注目し、その多極性細胞における役割が検討された形だ。
まず、LpdのメッセンジャーRNAとタンパク質が多極性細胞に存在することを確認した後、その発現を「shRNA(short hairpin RNA)」により抑制する実験が行われた。すると、多極性細胞の突起は減少することが確認されたのである。
培養細胞レベルの実験から、Lpdは「Mena」や「VASP」などの別のタンパク質=「Ena/VASPファミリータンパク質」を細胞膜に連れて来ることで、アクチン線維の動態を制御する仕組みを持つ。そこで、これらのタンパク質に関して、多極性細胞の突起形成への役割が検討されたのである。
まず、Ena/VASPタンパク質が多極性細胞に存在することが確かめられた。次に、細胞内のEna/VASPタンパク質を強制的にミトコンドリアに移行させて、細胞膜にあるLpdと結合できなくする人為的な組換えタンパク質「FP4-mito」作成して多極性細胞で発現させたところ、多極性細胞の突起が減少することが確かめられたのである。
興味深いことに、Lpdの発現をshRNAにより抑制した状態の多極性細胞に、Ena/VASPを強制的に細胞膜に移行させる組換えタンパク質「FP4-CAAX」を発現させると、突起が減少しなくなることがわかった。このことはLpdがMenaやVASPを細胞膜に移行させることにより、多極性細胞の突起形成を制御していることを示唆している。
次に、Lpd自体が細胞膜に移行する仕組みに関しての解析が行われた。Lpdは細胞膜に存在する「PI(3,4)P2」という「リン脂質」に結合することが知られている。PI(3,4)P2を多極性細胞で観察したところ、伸びている突起や、突起がこれから伸びようとする細胞膜上の小さな部位に集中して局在する可能性が示された。
PI(3,4)P2は、「PI(3,4,5)P3」という別のリン脂質から、酵素「SHIP2」によって「リン酸基」が1つ外される形で産生される。そこで、SHIP2の発現をshRNAによって阻害してみたところ、突起が減少した。また、SHIP2の酵素活性を阻害剤によって特異的に遮断したところ、やはり突起の減少が観察されたのである。
PI(3,4,5)P3はそれ自体で多くの生理活性を持っており、SHIP2はこれをPI(3,4)P2に分解することにより、PI(3,4,5)P3の働きを負に調節する作用が知られていたが、今回の研究により、多極性細胞の突起形成に関してSHIP2及びPI(3,4)P2が正の調節因子として機能することが判明した形だ。
最後に、Lpdの発現をshRNAで抑制した状態の細胞に通常のLpdタンパク質を発現させると、突起の減少が回復する一方で、Lpdタンパク質がPI(3,4)P2に結合するために必要な部分の「PHドメイン」を欠損させた変異型Lpdを発現させた場合には回復が認められないことが確認された。
これらの知見から、SHIP2が局所的にPI(3,4)P2を細胞膜上に産生し、そこにLpdが結合し、さらにLpdがEna/VASPといったアクチン線維の動態を制御する分子を連れてくることにより、多極性細胞の突起が形成されることが示唆されたのである(画像2・3)。
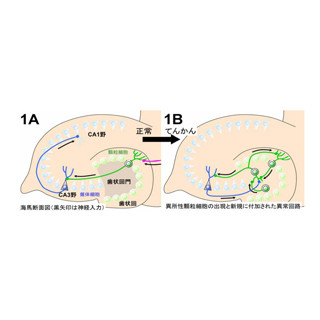
画像2は、今回の研究で明らかになった、多極性細胞が突起を伸縮する仕組みの一端を表した模式図。多極性細胞の突起やこれから突起が伸びる部分の細胞膜においてSHIP2タンパク質が活性化し、PI(3,4,5)P3がPI(3,4)P2に変換される。ここにラメリポディン(Lpd)タンパク質が結合し、さらにLpdはEna/VASPタンパク質を細胞膜に連れてくる。Ena/VASPはアクチン線維の動的調節を行う。
画像3は、アクチン線維が伸長した結果、突起が伸びるのを表した模式図。SHIP2-PI(3,4)P2-Lpd-Ena/VASPという一連の流れによって、アクチン分子の重合が促進された時、アクチン線維は伸張し、結果として突起は伸びる。今後の研究で、細胞外のシグナルが細胞内のSHIP2タンパク質の活性を変化させるメカニズムが解明できれば、多極性細胞がどのように周りの環境を探りとって自らの振る舞いを調節するかを明らかにできると期待される。
今回の研究では、多極性細胞の特徴的な突起の伸縮運動が、SHIP2、PI(3,4)P2、Lpd、Ena/VASPといった分子を介して、アクチン線維の重合/脱重合により制御されていることが明らかになった。
なお、今回は細胞内の仕組みを明らかにしたものだが、今後はどのような細胞外からのシグナルによってこの細胞内の仕組みが制御されているかを明らかにする必要があると研究グループは述べている。
特にSHIP2は、これら一連の分子の上位で働いているので、外界からのシグナルが受容体タンパク質によりキャッチされた後、SHIP2の酵素活性がどのような調節を受けるのか(=どのように細胞が場の空気を読んでいるか)が興味深い点だという。
これらを明らかにすることで、大脳皮質神経細胞の移動の初期過程がどのように精緻に制御されているのかを解明し、将来的には発達障害やてんかんの病態解明、治療法の開発へと繋げていきたいととした。