早稲田大学(早大)は4月17日、哺乳動物細胞の細胞分裂の進行が力によって外部制御可能であることを発見した。同成果は同大理工学術院の板橋岳志講師と石渡信一教授、同学術院の寺田泰比古教授、東京大学大学院の下山勲教授らの共同研究によるもので、「米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America:PNAS)」オンライン版に掲載された。
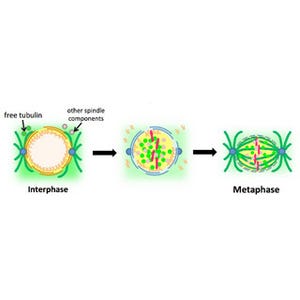
ヒトの体は、1個の受精卵から始まり、遺伝情報を集約する23対の染色体が、細胞分裂のたびに娘細胞へと1本たりとも間違えることなく正確に受け継がれることにより構成される。この染色体の分配に狂いが生じると、ダウン症などの疾患やがんなどの病気の原因となる。
この染色体分配のタイミングを決め、分配の異常を未然に防ぐ分子機構として「スピンドルチェックポイント」と呼ばれる監視機構が存在するが、これは、物理的な力と生化学的なシグナルのバランスによって制御させる細胞周期制御機構で、この制御機構について、これまで分子細胞生物学・細胞生物学的に各所で研究が進められてきた。
スピンドルチェックポイントが染色体の分配開始を決定するタイミングとしては、「微小管が正しくすべての染色体に結合しているか」ということと「適切な張力が働いているか」の2つが必須であると推測されてきた。しかし、学術的には、チェックポイントは張力を監視しておらず、染色体の結合のみを監視しているのではないかという意見もあり、近年、激しく議論が繰り広げられてきた。
こうした背景には、前述のとおり生化学的アプローチによる先行研究が多く行われてきたものの、それらは薬剤(重合・脱重合阻害剤)を用いて分オーダーで張力を減少させる手法であり、張力を増加させるとどうなるかといった研究などは哺乳類の実験として(ガラス管などで押さえると細胞膜が柔らかいため壊れてしまうことなどから)行われてこなかった。
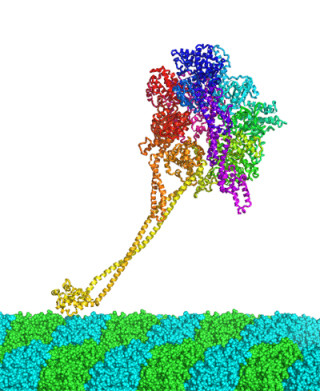
今回、研究グループは、下山教授らのグループが開発したMEMSカンチレバーを用いて「生物物理学的アプローチ」による染色体分配の開始機構メカニズムの解明に挑んだ。
具体的には、「細胞分裂装置に働く張力を外部負荷によって加減することで、染色体分配を開始するタイミングを強制的に制御できるか」という細胞生物(物理)学的な問いかけに向けてミクロンオーダーのカンチレバー2本(サイズは長さ200μm×幅30μm、厚さは0.3μmと15μm。ばね定数5-7nN/μm)で細胞を挟み、瞬時に圧縮・伸長する(「力パルス」を加える)手法を持って、外部負荷を定量的かつ可逆的に自在に制御して、さまざまな角度、状況で操作した。
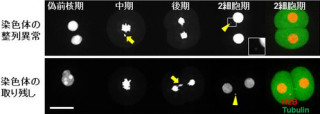
実際の実験には、細胞分裂期の哺乳動物培養細胞(ヒト子宮頸がん細胞:HeLa細胞)を使用(細胞サイズは20μm程度)。カンチレバーを用いて力パルスを加え、一瞬だけ圧縮すると、圧縮の方向や大きさに依存して、細胞内の紡錘体に働く張力を増減できることが判明した。たとえば、紡錘体に働く張力を減少させると(紡錘体に対し平行)、染色体分配開始タイミングは遅れ、一方、張力を増加させると(紡錘体に対し直行)、染色体分配時間は加速される結果となった(自然な分裂で20分程度だが、加速させた場合は統計的な結果として10分程度に早まった)。
また、チェックポイントタンパク質や細胞周期を制御するタンパク質の動態を解析した結果、有糸分裂中期の進行中に細胞が受けるさまざまな外部負荷に対して、異なるシグナル伝達機構が存在することが明らかとなったほか、薬剤処理によって染色体分配を抑制した細胞に適切な力パルスを加えると、ある割合で分配が開始されることも確認され、これらの結果は、さまざまな細胞機能が外部から物理的に補完・制御可能であることを示唆したものとなった。
なお、研究グループでは今回の成果を受け、「力がどの分子に効いて効果を発揮するのか、などの詳細に関してはまだ何もわかっていないし、今回の細胞はがん細胞であるため、正常な細胞でも同様の結果が得られるのかなどの研究もこれから進めていく必要があるため、それらを用いて、機構の理解を深めていく」(板橋講師)とするほか、この力による制御が、胚発生や組織あんどの形成過程において、例えば細胞間の多次元的位置取りなどに、どのような役割を担っているかなどについても今後、明らかにしていきたいとしている。
また、今回の細胞力学操作の手法と成果は、染色体分配の動作・制御メカニズムの解明だけでなく、力による細胞機能の外部制御、そして生体組織の再構成などの組織工学や再生医療への応用も期待できるとしている。