まず、細胞内アセチルCoAを効率よく活性化するための触媒分子のデザインが行われた。触媒は大きく2つの機能を持った部位からなり、1つはアセチルCoAのアセチル基を触媒分子に取り込むための部位である「チオール基」、もう1つは取り込んだアセチル基を活性化してリジン残基と反応させるための触媒中心となる部位である。
後者の触媒中心には、研究チームで過去に開発された細胞内環境でも高い触媒活性を示す「ヒドロキサム酸型」の骨格が用いられた。反応の要となる触媒中心の性質が変化するよう、少しずつ構造を変えた複数の触媒候補分子が合成され、そのヒストンアセチル化活性を比較したところ、触媒分子「mBnA」が最も優れた活性を有することが判明したという。
-
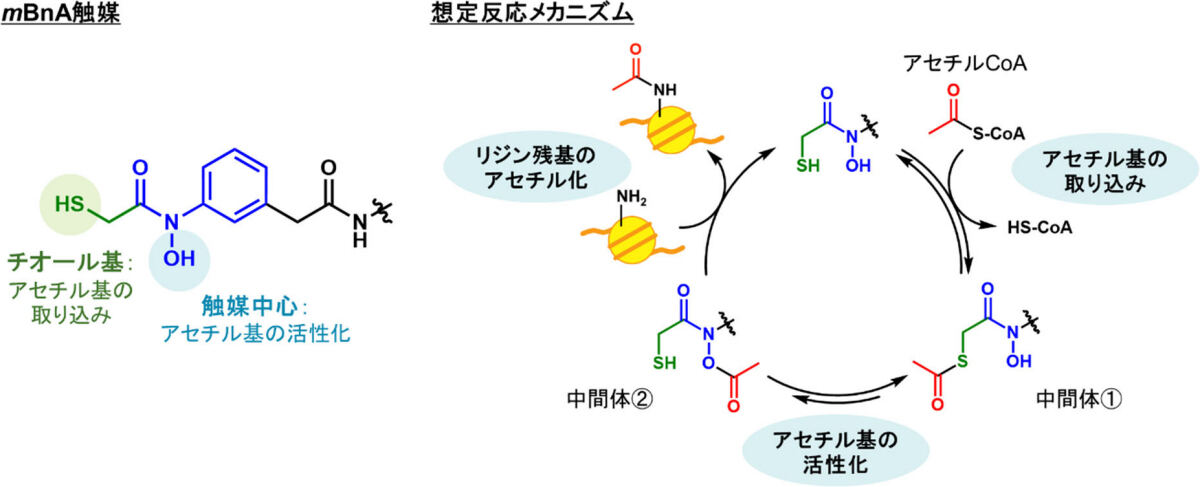
(左)反応性が低く、細胞内の存在量が少ないアセチルCoAを効率よく活性化するため、アセチルCoAからアセチル基を素早く取り込むための部位としてチオール基が、取り込んだアセチル基を強力に活性化するための部位としてヒドロキサム酸型の構造を有する触媒中心が、それぞれ分子内に組み込んだ触媒構造がデザインされた。(右)反応は、2つの中間体を経由しながら進行するものと想定された。(出所:共同プレスリリースPDF)
開発されたmBnA触媒をヒト細胞に添加したところ、アセチル源を加えていないにも関わらず、ヒストンのアセチル化が進行することが確認されたとのこと。そしてこの時、mBnA触媒はヒト細胞内の代謝経路で産生されるアセチルCoAを反応に用いていることが、実験的に明らかにされた。
さらに、細胞内にはアセチルCoA以外にも類似の構造を持つ代謝物が存在しており、mBnA触媒はその1つである「マロニルCoA」を用いて、ヒストンのマロニル化反応も行えることが突き止められた。マロニルCoAはヒストンアセチル化酵素のポケットにはうまくはまらないことから、酵素が反応に使うことのできない代謝物とされており、化学触媒は、生体内の酵素機能を代替するだけでなく、酵素にない機能を発揮する可能性も有するといえるとする。
またそれらに加え、mBnA触媒によるヒストンアセチル化反応の進行度が、細胞内アセチルCoA量の指標となることも提示したという。ヒストンは細胞の核に存在することから、核およびそれとつながった細胞質区画に存在するアセチルCoAのみを検出することが可能で、そのためこれまで困難だった生細胞内の特定区画におけるアセチルCoAの検出が可能となったとしている。
-
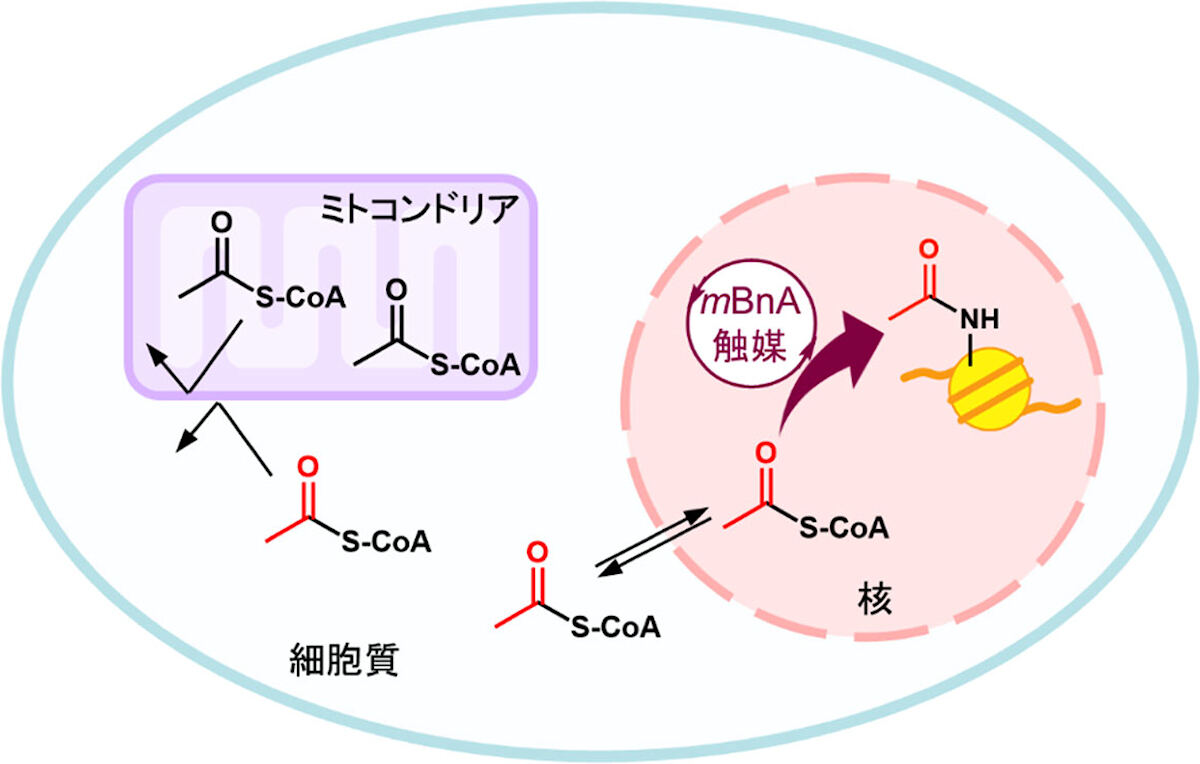
細胞内において、アセチルCoAは核・細胞質・ミトコンドリアにおいて生合成される。アセチルCoAは、細胞や細胞内小器官の膜を通過できないため、ミトコンドリア内のアセチルCoAは、他の区画と独立して存在している。一方、核を覆う膜には「核膜孔」があるため、核と細胞質に存在するアセチルCoAは同穴を介して互いに往来が可能。つまり、mBnA触媒が核内でヒストンをアセチル化するのに用いることのできるアセチルCoAは、核-細胞質に存在するものに限られる。触媒によるヒストンアセチル化の進行度から核-細胞質のアセチルCoA量の変化を知ることができ、細胞内の特定区画におけるアセチルCoA量の検出手法となることが期待されるとした。(出所:共同プレスリリースPDF)
研究チームは今回の成果について、mBnA触媒が、核-細胞質区画におけるアセチルCoA代謝とヒストンアセチル化の関連を調べるための生化学研究用ツールとしても応用可能なことを示すものであるといえるとする。
加えて今回の成果は、生体内のヒストンアセチル化酵素の機能を代替・補完することで、細胞内の化学反応ネットワークに介入することのできる低分子化学触媒を開発していく上での足掛かりとなるといい、ヒストンアセチル化を介した疾患治療の可能性を拡張するものと期待されるとしている。