東京大学(東大)と千葉大学の両者は9月22日、細胞内にアセチル源として存在する代謝物「アセチル補酵素A」(アセチルCoA)を酵素のように活性化してヒストンのアセチル化反応を促進させる、低分子化学触媒の開発に成功したことを共同で発表した。
同成果は、東大大学院 薬学系研究科 有機合成化学教室の金井求教授、同・山次健三助教(現・千葉大大学院 薬学研究院 教授)、同・川島茂裕准教授らの研究チームによるもの。詳細は、英オンライン科学誌「Nature Communications」に掲載された。
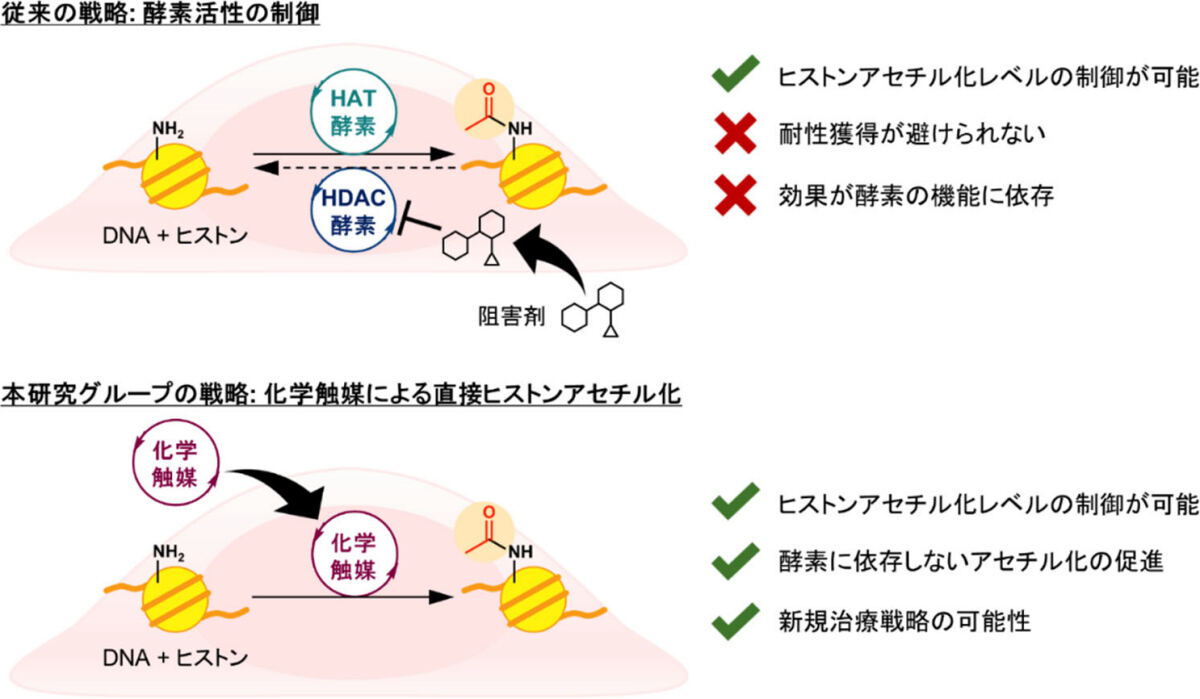
低分子による酵素機能の制御によって効果を発揮する抗がん剤は複数存在する。しかし、酵素の変異による耐性獲得が避けられないことに加え、そもそもヒストンをアセチル化する酵素の機能が低下していると、脱アセチル化を抑えてもアセチル化レベルが上がらない可能性が懸念されていた。
それに対し研究チームでは、ヒストンアセチル化のような生命活動にとって意味のある生体内化学反応を、酵素に頼らず直接進行する化学触媒を開発できれば、新たな創薬概念になるのではないかと考察したとのこと。そしてこれまでの研究で、細胞内でタンパク質の「リジン残基」をアセチル化できる化学触媒を開発することに成功している。
この触媒は、アセチル源を活性化して、タンパク質リジン残基上へとアセチル基を移すという反応を行うことができる。しかし、細胞内にはヒストンアセチル化酵素が反応に用いるアセチルCoAがすでに存在しているにも関わらず、従来の化学触媒はいずれも細胞外から人工的なアセチル源を加えないと反応が進行していなかったとする。
アセチルCoAは、「チオエステル」と呼ばれる比較的反応性の低い形でアセチル基を有しており、細胞内濃度も数マイクロモル(μM)から数十μMと、代謝物としては低くとどまっていた。そのような細胞内アセチルCoAを直接活性化することは化学的に困難であり、従来の化学触媒ではそれを実現できていなかったという。そこで研究チームは今回、外からアセチル源を添加することなく、細胞内のアセチルCoAのみをアセチル源として用いてヒストンをアセチル化できる、高活性な化学触媒の開発に取り組んだとする。