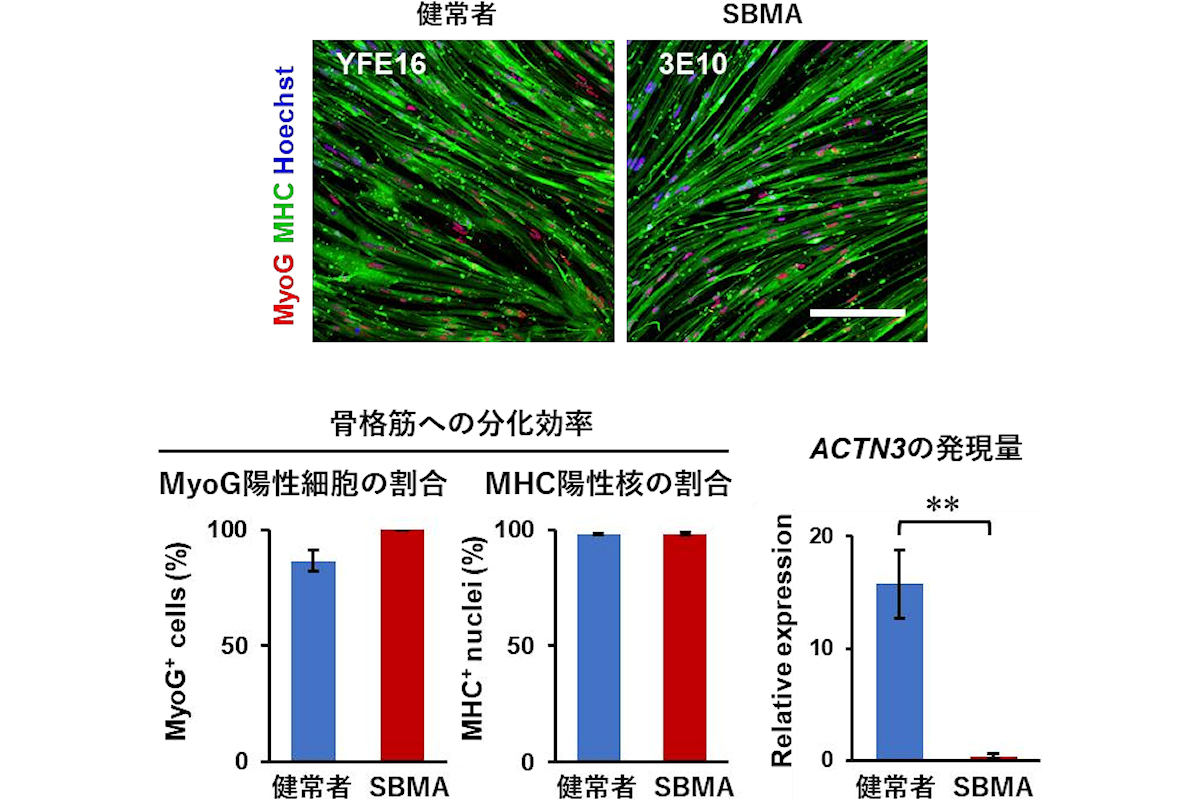
実験ではまず、ヒトiPS細胞へのMYOD1遺伝子の導入が行われた。そして、抗生物質「ピューロマイシン」による薬剤選択を行い、ドキシサイクリン誘導性にMYOD1を発現するヒトiPS細胞株(MYOD1-hiPSC)を作製した。その結果、従来行ってきたクローン選択を行わなくても、バルク培養(細胞の樹立の過程で、クローン選択を行わずにMYOD1を発現する細胞を回収してくること)で作製したMYOD1発現ヒトiPS細胞から、80%以上という高効率で、「Myogenin(MyoG)陽性」および「ミオシン重鎖(MHC)陽性」骨格筋細胞を分化誘導し得ることが見出されたという。また、バルク培養で作製したMYOD1-hiPSCを用いることで、クローン間のばらつきを最小限に抑えられる可能性があることも見出されたとする。
続いて、同手法を用いてSBMA患者由来iPS細胞を骨格筋へと分化誘導したところ、健常者株と同様に高効率に骨格筋へと分化誘導が可能だったとする。また、健常者iPS細胞由来骨格筋に比べ、速筋マーカーである「ACTN3遺伝子」の発現が低下していることが見出された。この結果は、SBMA患者由来骨格筋で見られる変化が、同患者やSBMAモデルマウスで見られている速筋の減少をよく反映していると考えられるとのこと。つまり、同手法は疾患解析にも応用可能であることが示されたという。
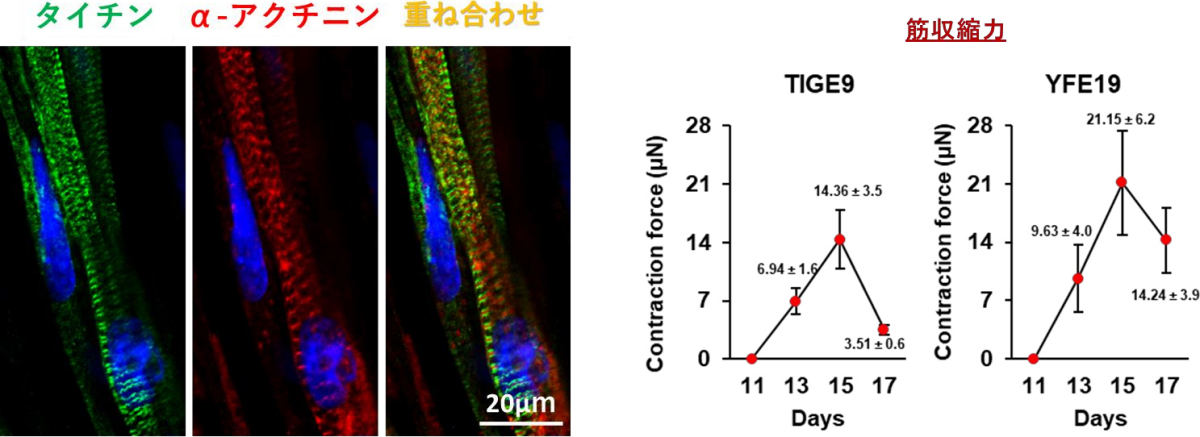
さらに、バルク培養で作成されたMYOD1-hiPSCから3次元骨格筋を作製したところ、電気刺激により筋収縮を得ることに成功したとする。したがって、同手法によりヒトiPS細胞から誘導された骨格筋は機能的であることが考えられたとしている。
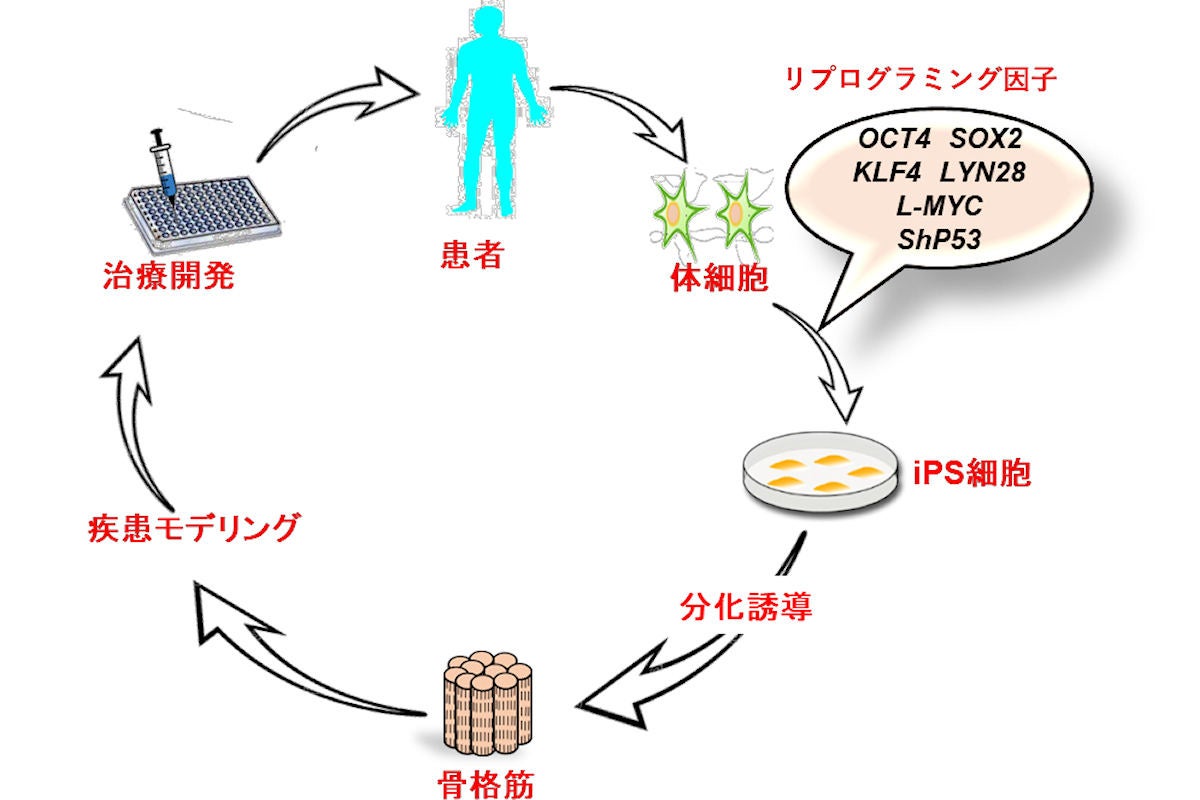
今回の研究では、従来のヒトiPS細胞からの骨格筋分化誘導法はクローン選択が必要だったが、今回のバルク培養での骨格筋分化誘導法により、機能的な3次元の骨格筋を作製し得ることが示された。既存手法よりも時間と労力がかからず、効率的に筋疾患モデルの作製が容易になるため、研究チームは今後の病態解明や治療開発の促進につながることが期待されるとした。