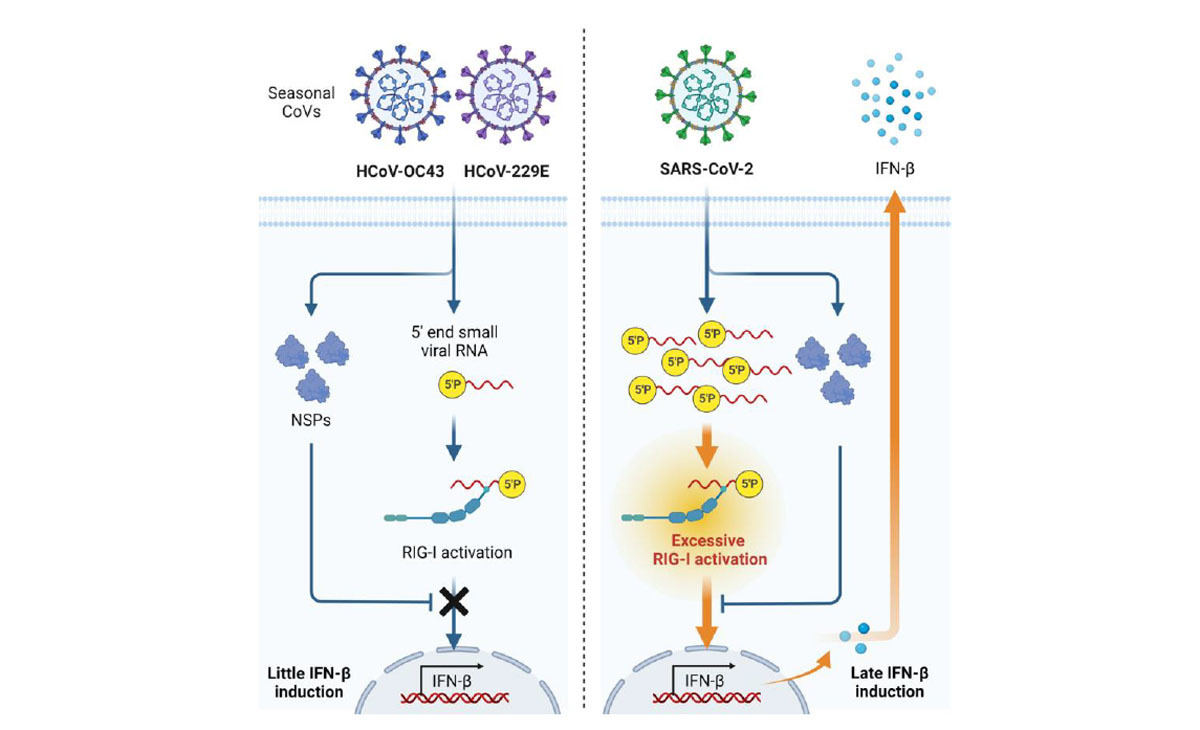
具体的には、培養細胞を用いた実験により、風邪コロナウイルス(OC43株および229E株)と異なり、SARS-CoV-2はヒト細胞において感染極期に遅れて強くインターフェロン産生を誘導することを確認したとするほか、短鎖ウイルスRNAを効率よく解読する独自に確立したRNAシーケンス法を用いた研究から、風邪コロナウイルスと異なり、SARS-CoV-2はウイルスゲノムRNAの5'末端領域の断片を大量に産生することが判明したとする。
また、各種RNAを細胞導入する実験から、SARS-CoV-2が産生するこれらの短鎖ウイルスRNAが生体分子であるRIG-I(Retinoic acid-inducible gene-I)を刺激することでインターフェロン誘導を規定することも発見したとするほか、ヒト気道再構築モデルやハムスター感染モデルを用いた感染実験から、短鎖ウイルスRNAの蓄積とインターフェロン産生が同期していることが判明したとする。
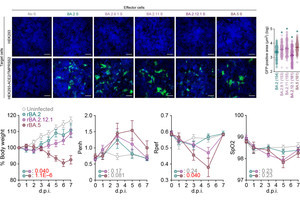
加えてハムスター感染モデルにおいては、SARS-CoV-2の初期株とデルタ株が短鎖ウイルスRNAを同程度に肺で産生するのに対し、オミクロン株(BA2系統)では産生量が低下しており、この傾向は生体内の免疫応答の程度と一致していることも確認したとする。
研究グループは今回の研究結果について、コロナウイルス科に属するウイルス間や新型コロナウイルス変異株間で短鎖ウイルスRNA産生量が異なり、それがCOVID-19の重症度の程度と関連する可能性があることを示唆していると説明しており、季節流行性の風邪コロナウイルスが一般的な「かぜ」を引き起こすことに対し、SARS-CoV-2がサイトカインストームを特徴とする重篤化を引き起こす理由の一部を解き明かすものであると考えられると説明している。
なお、今回の研究は、実験的な感染モデル(in vitro, ex vivo, in vivo)を用いた実験によるもので、ウイルスによるゲノムRNA断片の蓄積量と臨床症状の情報は紐づけられていないため、患者ごとのウイルスRNAの蓄積量とCOVID-19の重症度の関連は不明なままであるとしており、研究グループでは今後、患者を対象に生体におけるウイルスRNA量と重症度との関連性を検証する方針だとしている。