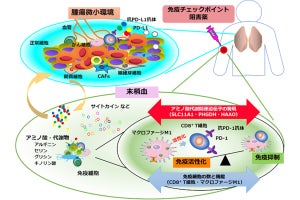
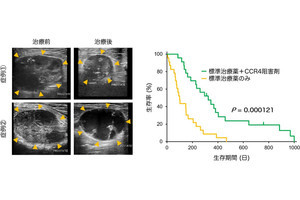
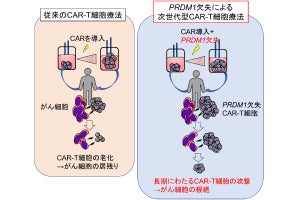
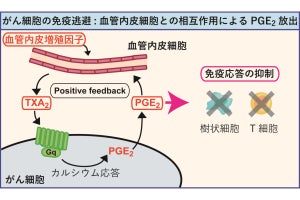
名古屋大学(名大)と科学技術振興機構(JST)は8月22日、がんの不均一性を克服しうる新技術として、がん局所に「抗体薬剤複合体」(ADC)を集積させ、光でがんを破壊すると同時に抗がん薬を周囲に放出する「光応答性スマート武装抗体」(光応答性Smart ADC)を開発し、その新しい効果を「光バイスタンダー効果」と命名したことを発表した。
同成果は、名大大学院医学系研究科・病態内科学講座呼吸器内科の高橋一臣大学院生(現・中部ろうさい病院呼吸器内科)、同・佐藤和秀特任講師(名大高等研究院B3ユニットフロンティア長/JST創発的研究支援事業1期生兼任)、名大未来社会想像機構ナノライフシステム研究所/量子科学技術研究開発機構(QST)量子生命科学研究所の馬場嘉信教授・所長、QSTの湯川博特任教授・QSTプロジェクトディレクター、米・国立衛生研究所/国立がん研究所の小林久隆主席研究員らの国際共同研究チームによるもの。詳細は、米国化学技術協会とその技術コミュニティの米国生体工学学会が共同で刊行する化学および生物工学を扱うオープンアクセスジャーナル「Bioengineering & TranslationalMedicine」に掲載された。
近赤外光線免疫療法(NIR-PIT)は、がん細胞が発現するタンパク質を特異的に認識する抗体と光感受性物質「IR700」の複合体を合成し、細胞表面の標的タンパク質に結合させた状態で近赤外光を照射してがん細胞を破壊する。手術・放射線・化学療法・がん免疫療法に続く、“第5のがん治療法”として期待されている。
しかし、固形がん表面の標的抗原に対しての抗体治療には、その高い標的性によって固形がんの不均一性の1つである標的抗原の不均一発現により、効果が限定されてしまうという臨床上の課題を抱えていたという。現状、その不均一性の克服はできておらず、がんの再発や治療効果の限定につながっているとする。そこで研究チームは今回、その課題の克服を試みることにしたという。
具体的には、がん特異抗原「HER2」に対する認可済み抗体医薬「トラスツズマブ」(Tra)と、Traに抗がん剤「DM1」を付加したADC「トラスツズマブエムタンシン」(T-DM1)にIR700を付加して、「Tra-IR700」と「T-DM1-IR700」を作成。T-DM1は、構造的に生体内では結合したがん細胞内に取り込まれた後でしかDM1を放出しない仕組みを持っており、静脈注射後に安定してがん部位に集積した後に、がん細胞表面のHER2受容体に結合してがん細胞内に取り込まれて効果を発揮するという。