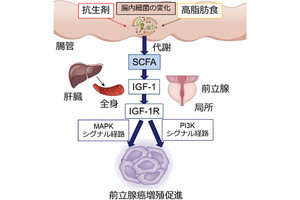
京都大学(京大)は5月28日、がん細胞から放出され免疫の働きを抑制する「プロスタグランジンE2」(PGE2)に着目し、その放出を制御するメカニズムの解明を試みるために二光子顕微鏡を用いてマウス生体内のがん細胞を観察したところ、カルシウム応答がPGE2放出の誘因であることを見出したと発表した。
さらにこのカルシウム応答は、血管内皮細胞増殖因子の刺激に応じて血管内皮細胞から分泌される「トロンボキサンA2」が腫瘍細胞に働くためであることが見出されたことも合わせて発表された。
同成果は、京大 生命科学研究科の松田道行教授、同・医学研究科の寺井健太准教授、同・小西義延研究員(現・ダナファーバーがん研究所研究員)らの研究チームによるもの。詳細は、国際学術誌「Cancer Research」にオンライン掲載された。
本来は周囲の細胞と協力して生命を維持していたはずの細胞はがん化すると、まるで悪意のある知性を得たかのように、巧みな戦略を駆使して生き残り、成長していく。最大の敵である免疫の働きに対しては、抑制する物質を放出したり、その働きを阻害する細胞を呼び込んだりするなど、自身を取り巻く「腫瘍微小環境」を改変し、免疫からの攻撃を回避することが知られており、この現象は「免疫逃避」と呼ばれ、がん治療において重要視されている。
がん細胞が免疫抑制のために放出する物質の代表的存在として、プロスタグランジンE2(PGE2)がある。PGE2は以前より注目を集めてきた物質であるが、がん細胞によるPGE2の放出を制御する機序についてはよくわかっていなかったという。そこで研究チームは今回、がん細胞からのPGE2放出を制御する細胞同士の相互作用解明を目的とした研究に挑んだという。
具体的には、細胞内のPGE2産生はカルシウム応答により惹起されることから、生きたマウス体内のがん細胞カルシウム応答を観察し、薬剤投与や遺伝子改変技術を用いてPGE2放出の制御メカニズムの解明が試みられた。
二光子顕微鏡にてマウス皮下に移植されたがん細胞の観察を行ったところ、腫瘍微小環境内(生体内)の一部のがん細胞において、活発なカルシウム応答が観察されたとするほか、このカルシウム応答は、がん細胞単独培養(生体外)では観察されず、がん細胞とほかの細胞との細胞間相互作用により、カルシウム応答が惹起されていることが示唆されたとする。
-
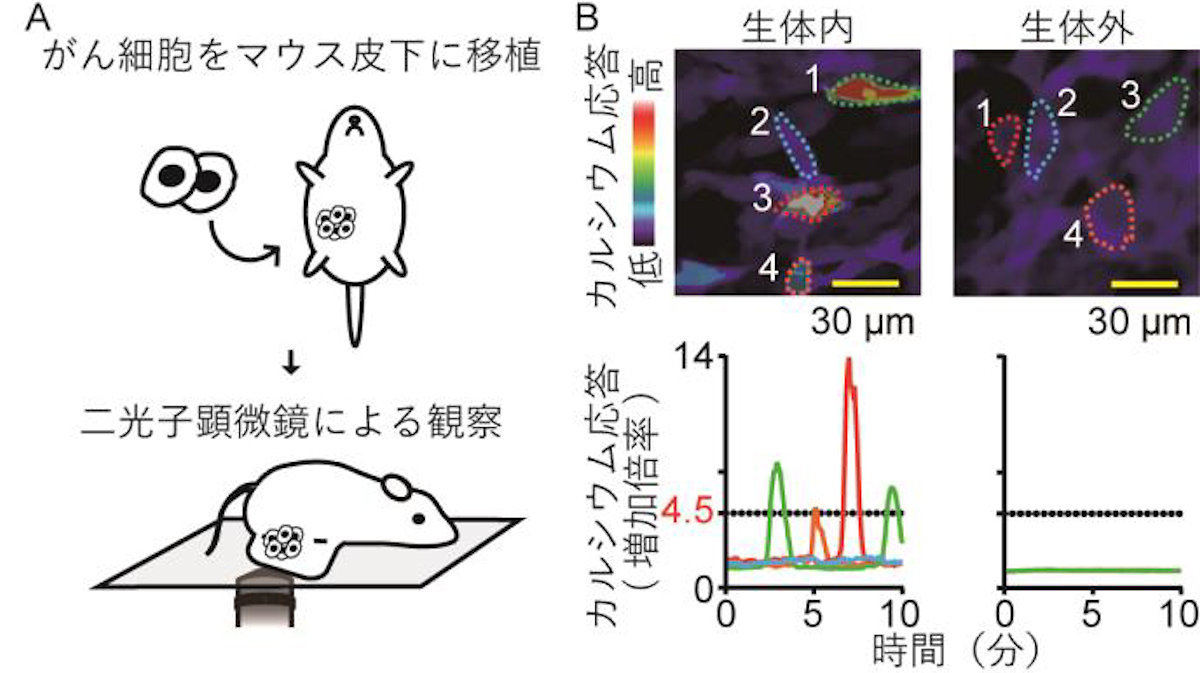
カルシウム応答の観察。(A)今回の研究では、がん細胞がマウスの皮下に移植され、二光子顕微鏡によって観察された。(B)がん細胞の生体内と生体外でのカルシウム応答の差。生体外でがん細胞を単体で培養してもカルシウム応答は観察されない (出所:京大プレスリリースPDF)
また、がん細胞のカルシウム応答を惹起する、がん細胞上の受容体の探索が行われた結果、「トロンボキサンA2(TXA2)受容体」を欠損させたがん細胞では、以下の3点が明らかとなったという。
- カルシウム応答が抑制されること
- 腫瘍微小環境内のPGE2濃度が低下すること
- 免疫によるがん細胞の排除が達成されること
-
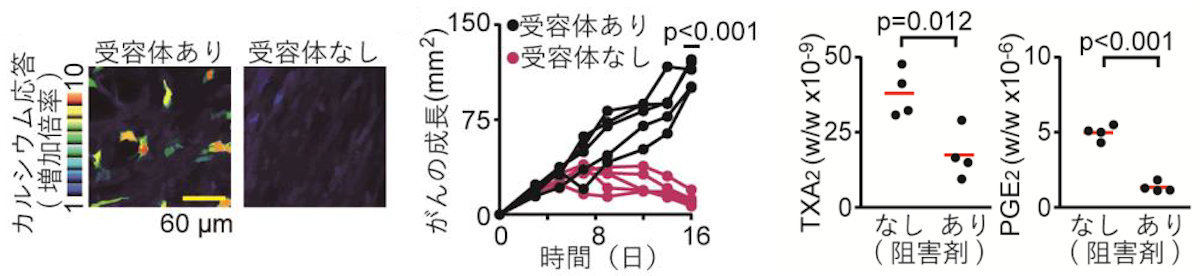
(左)TXA2受容体欠損によるカルシウム応答の消失。受容体があると明るい色をした、カルシウム応答が増加している部分が複数箇所で見られるが、受容体がないと明るい色がなくなる。(中央)TXA2受容体欠損による免疫応答の惹起。受容体があるとがんが成長していくが、受容体がないと途中から下降線になる。(右)血管内皮増殖因子の阻害効果。赤線の位置から、TXA2、PGE2ともに阻害剤が大きく効果を発揮していることがわかる (出所:京大プレスリリースPDF)
さらに、血管新生を促すタンパク質である「血管内皮増殖因子」の特異的な阻害剤を投与することで、腫瘍微小環境内のTXA2濃度、そしてPGE2濃度が低下することも見出されたとした。
研究チームによると、がん細胞は周囲の細胞を“だます”ために積極的なコミュニケーションを取っており、PGE2はその手段の一種であり、PGE2を使って血管にある「新生したい」という“習性”を巧みに悪用していると例えることができるとしており、がん細胞が血管を悪用できないようにすることがポイントだとする。
-
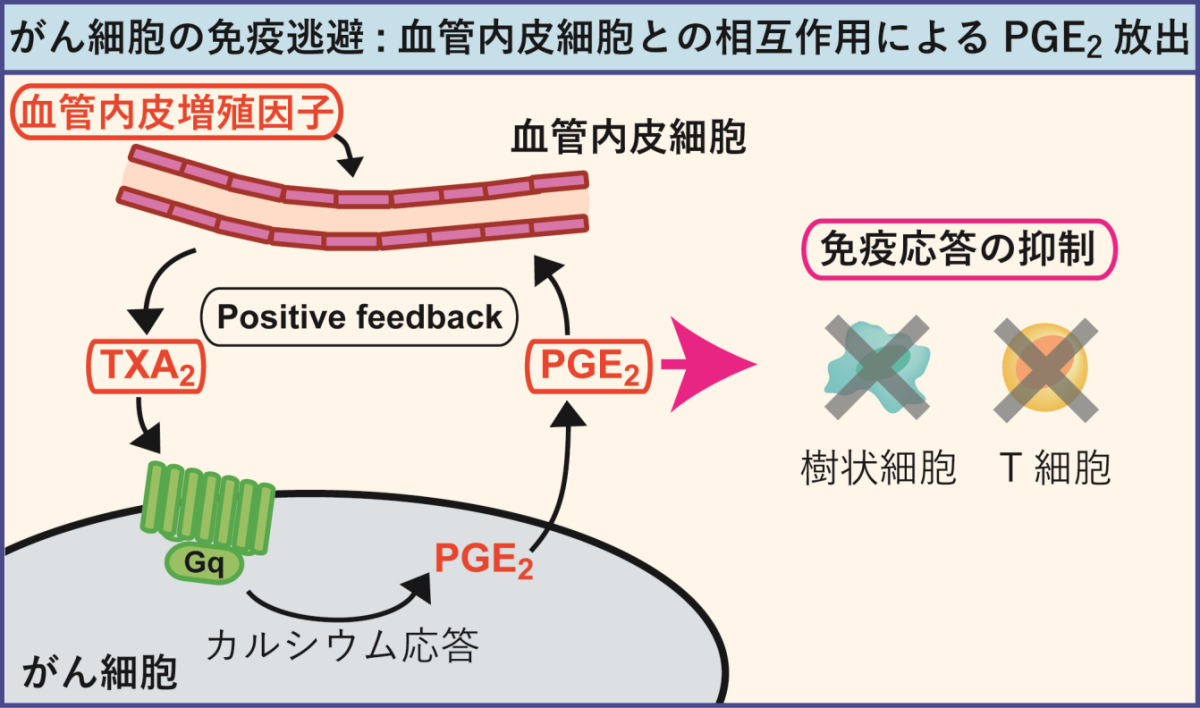
今回の研究成果により判明した、がん細胞の免疫逃避の模式図。血管内皮増殖因子の刺激に応じて血管内皮細胞からTXA2が放出され、それががん細胞のカルシウム応答を惹起。そしてPGE2が放出されることで、免疫応答を抑制させると同時に、再びTXA2を放出させるというフィードバックループを形成。このループを壊すことが、がんに免疫逃避をさせない方法の1つであることが今回の研究から判明した (出所:京大プレスリリースPDF)
なお、血管内皮増殖因子の阻害によって、がんに対する免疫応答が増強されることは、臨床試験の成果としてこれまでにも少数だが報告されていたという。今回の研究は、その臨床効果の分子メカニズムの一端が明らかにするもので、今後、免疫チェックポイント阻害剤などほかの免疫療法との組み合わせを含めた、新規がん免疫療法の開発につながると期待されるとしている。