東京大学(東大)、東北大学、横浜市立大学(横市大)、関西医科大学(関西医大)、京都大学(京大)、日本医療研究開発機構の6者は8月6日、クライオ電子顕微鏡による単粒子解析法を用いて、睡眠の誘導で中心的な役割を果たす「メラトニン」の受容体である「MT1」と、細胞内情報伝達に関わる「Giタンパク質三量体」で構成されるシグナル伝達複合体の立体構造を解明したと発表した。
同成果は、東大大学院 理学系研究科 生物科学専攻の岡本紘幸大学院生、東北大大学院 薬学研究科の井上飛鳥准教授、東大大学院 理学系研究科 生物科学専攻の西澤知宏准教授(研究当時、現・横市大大学院 生命医科学研究科 生体膜ダイナミクス研究室 教授)、東大大学院 理学系研究科 生物科学専攻の濡木理教授、関西医大 医学部 医化学講座の寿野良二講師、同・清水(小林)拓也教授、京大大学院 医学研究科 分子細胞情報学分野の野村紀通准教授、同・岩田想教授らの共同研究チームによるもの。詳細は、「Nature Structural and Molecular Biology」に掲載された。
メラトニンはトリプトファンを出発物質にセロトニンを経て、脳の松果体で合成されるホルモンで、夜間に分泌され、睡眠の誘導や概日リズムの制御に関与していることが知られている。
分泌されたメラトニンは、膜受容体タンパク質である「Gタンパク質共役受容体」(GPCR)の一種である「メラトニン受容体」に結合する。Gタンパク質とは細胞内情報伝達に関わるGTP結合タンパク質のことで、Gα、Gβ、Gγというサブユニットの三量体によって構成され、そのうちのGαサブユニットは4種類に大別され、その1つが「Giタンパク質三量体」と言われる。
メラトニンは、結合することでメラトニン受容体を活性化させ、活性化したメラトニン受容体が、選択的にGiタンパク質三量体を活性化させる。Giタンパク質三量体は、下流でアデニル酸シクラーゼの活性を阻害することで、抑制性のシグナルを伝達し、最終的に睡眠の誘導などの生理作用をもたらすことが知られている。
これらの生理作用の重要性から、メラトニンおよびメラトニン受容体は、睡眠障害などの治療標的として注目を集めている。すでに多くの作動薬が開発され、臨床に用いられているところだが、すべての仕組みが理解された上でこれらの作動薬が開発されたわけではなく、どのようにしてメラトニン受容体に作用してシグナルを伝えるのかに関して、実はまだあまりわかっていないという。
こうした背景を踏まえ研究チームは今回、クライオ電子顕微鏡による単粒子解析法を用いて、リガンドが結合し活性化したメラトニン受容体MT1およびGiタンパク質三量体で構成されるシグナル伝達複合体の立体構造の解明に挑戦。解明に成功し、メラトニン受容体が活性化するメカニズムを明らかにすることができたという。
-

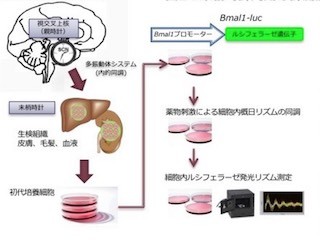
メラトニン受容体MT1-Giシグナル伝達複合体の全体構造。(左)メラトニン受容体MT1-Giシグナル伝達複合体の密度マップ。(右)密度マップに基づいて構築したメラトニン受容体MT1-Giシグナル伝達複合体の立体構造モデル (出所:東大Webサイト)
また、東北大の井上准教授が開発したGiタンパク質三量体の活性化検出法を用いたメラトニン受容体の変異体解析により、先行研究では明らかとなっていなかった受容体の活性化に重要なアミノ酸残基を新しく特定することにも成功。
-

活性化状態のメラトニン受容体MT1による作動薬ラメルテオンと認識機構。(左)メラトニン受容体MT1-Giシグナル伝達複合体の全体構造。(右)リガンド結合部位の拡大図。薄紫色で囲ったアミノ酸残基(T188、V191、V192、L254)がメラトニン受容体の活性化に重要であることが今回初めて発見された。これらのアミノ酸残基は第5、第6膜貫通ヘリックス(TM5・TM6)に存在し、多くのGPCRの間で保存されている「活性化モチーフ」と呼ばれるアミノ酸残基群の近くに位置していることが判明した (出所:東大Webサイト)
GPCRによって活性化されるGタンパク質にはいくつかの種類があり、MT1はGiタンパク質を選択的に活性化することがわかっている。GPCRは一般的に活性化に際して6番目の膜貫通ヘリックス(TM6)が構造変化することが知られているが、MT1受容体ではほかのGiシグナル伝達受容体に比べてTM6が大きく跳ね上がるように動くことが見出されたという。
-

不活性化型の結晶構造とシグナル伝達複合体の構造を比較。メラトニン受容体MT1(左)、μオピオイド受容体(中央)、β2アドレナリン受容体(右)のそれぞれのTM6について、不活性化型の構造を取っている結晶構造と、活性化状態の構造を示すシグナル伝達複合体の構造が比較された。メラトニン受容体MT1の第6膜貫通ヘリックス(TM6)は、ほかのGiシグナル伝達受容体に比べて大きく構造変化し、Gsシグナル伝達受容体と同程度まで跳ね上がりを示していたとした (出所:東大Webサイト)
これまでの研究から、Giシグナル伝達受容体ではGsシグナル伝達受容体に比べ、このTM6の構造変化が小さく、この違いが共役するGタンパク質の選択性を決めていると考えられてきた。一方、今回明らかにされたMT1受容体では、Gsシグナル伝達受容体と同程度の大きさでTM6の構造変化が確認された。つまり、このTM6の動き自体はGタンパク質シグナルの選択性とは直接的には関係がなく、TM6の構造変化の程度はむしろTM6の疎水性アミノ酸の分布に大きく依存することが示唆されたという。
一方で、GPCRの構造が網羅的に比較された結果、Giシグナル伝達受容体では、細胞内側の空間がGsシグナル伝達受容体に比べて狭いという特徴が判明したほか、Gsシグナル伝達受容体に比べ、Giシグナル伝達受容体では細胞内ループなどを介した相互作用が弱く、GiのC末端のみで相互作用していることが明らかにされた。
-

Giシグナル伝達受容体とGsシグナル伝達受容体の構造を比較。Giシグナル伝達受容体(左:メラトニン受容体MT1、右:μオピオイド受容体)とGsシグナル伝達受容体(左:β2アドレナリン受容体、右:アデノシンA2A受容体)のそれぞれについて、細胞内側から見た構造が比較された。Giシグナル伝達受容体は細胞内側の空間が狭い一方で、Gsシグナル伝達受容体では細胞内側の空間が比較的広いことが見て取れる (出所:東大Webサイト)
また、伊・Scuola Normale Superiore di PisaのRaimondi准教授による構造情報を用いたバイオインフォマティクス解析の結果から、Gsシグナル伝達受容体間ではGタンパク質と受容体の相互作用が保存されている一方で、Giシグナル伝達受容体ではばらつきが大きく、受容体ごとにやや柔軟な相互作用を形成していることが解明された。
以上から、Gi共役とGs共役の選択性はTM6の構造変化の程度の違いだけで決まるという従来の考えに対し、受容体の細胞内側の空間的な特徴や、細胞内ループを介したGタンパク質との相互作用など、より多くの要素が複合的に選択性に寄与することが明らかにされた。
今回の研究における活性化型のメラトニン受容体の立体構造と、先行研究のX線結晶構造解析による不活性型の立体構造とを組み合わせることで、コンピュータシミュレーションによるメラトニン受容体の薬剤探索が加速し、不眠症や時差ボケといった概日リズムの乱れによる体調不良に対する治療薬の開発へとつながることが期待されるとしている。