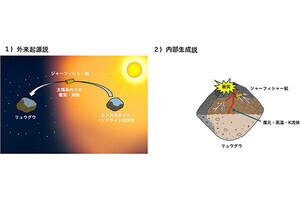
東北大学は8月30日、合成終盤に硫黄および窒素原子の架橋構造を構築する独自の合成戦略により、これまで有効な化学合成法が存在しなかった海洋アルカロイドの「ディスコハブディンB」の不斉全合成を達成したことを発表した。
同成果は、東北大大学院 薬学研究科の徳山英利教授らの研究チームによるもの。詳細は、米国化学会が刊行する機関学術誌「Journal of the American Chemical Society」に掲載された。
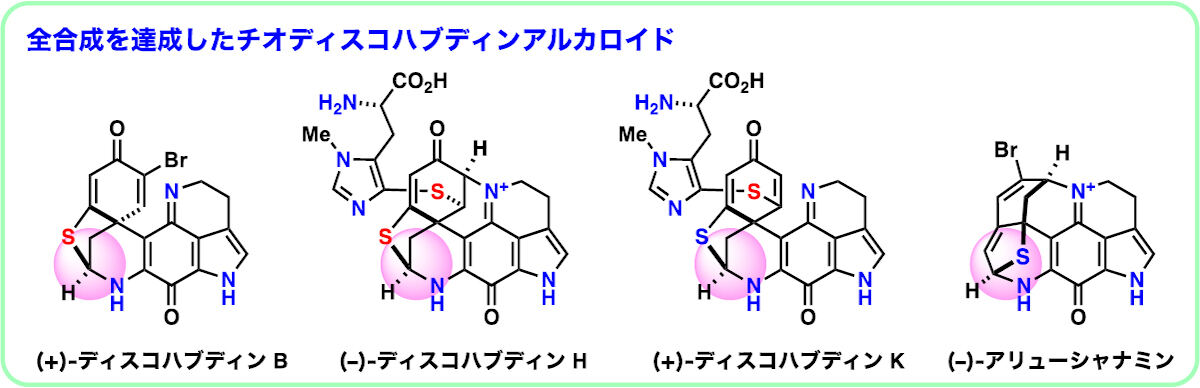
これまでに50種以上が確認されているディスコハブディン類は、Latrunculia属の海綿から単離される海洋アルカロイドの一種だ。同化合物は、抗腫瘍活性や抗マラリア活性など多様な生物活性を示し、中でも抗がん剤の候補化合物として期待されている。
数多く存在するディスコハブディン類の中でも、類縁大群の大部分(34種)を占めるのが、硫黄および窒素原子の架橋構造を有する「チオディスコハブディン」だ。しかし、この架橋構造を含む複雑な多環状骨格の合成難易度が極めて高いため、化学合成が実現したのはわずか1種類のみだったという。
また、チオディスコハブディンの大半は海面からの単離量が極微量であり、創薬研究が十分に行われていないのが現状だという。そのため、同化合物に関する新たな創薬研究を推進するためには、硫黄、酸素および窒素原子を含む多環性骨格の効率的構築法の開発が求められるだけでなく、30種を超える類縁化合物への誘導化を指向した柔軟な合成戦略の設計が必要不可欠だった。
そこで研究チームは今回、チオディスコハブディン類の網羅的化学合成と、それらを活用した創薬研究を見据え、最初に鍵中間体となるディスコハブディンBの合成研究を開始したとする。
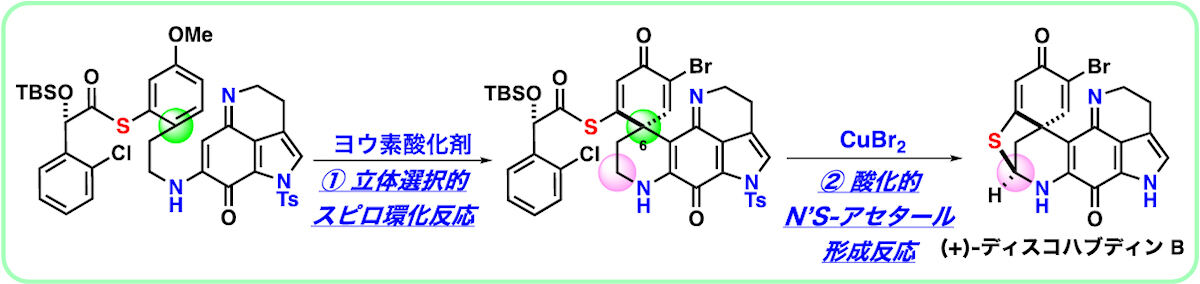
今回の研究では、独自に開発された「光学活性チオエステル」を不斉補助基とする「酸化的スピロ環形成反応」により、合成上の課題となる「C6位」の第四級不斉炭素の立体選択的構築が実現された。
もう1つの合成課題となる、高度に歪んだ硫黄および窒素原子の架橋構造の構築については、同じく独自に開発された銅触媒を用いる連続反応によって達成されたとする。
研究チームによると、今回の研究で重要なのは、“硫黄原子の保護基の除去“、“アミンのピンポイント酸化反応”、および“環化反応による硫黄および窒素原子の架橋構造の構築”を含む3種の反応が、順序よく連続的に進行することだという。この反応の特筆すべきポイントは、酸化条件に弱くジスルフィド結合を形成して容易に不活性化してしまう硫黄原子存在下でも、問題なく進行する高い官能基共存性だ。以上の独創性の高い合成戦略に基づき、市販されている出発原料からわずか12工程でディスコハブディンBの不斉全合成が達成されたとしている。
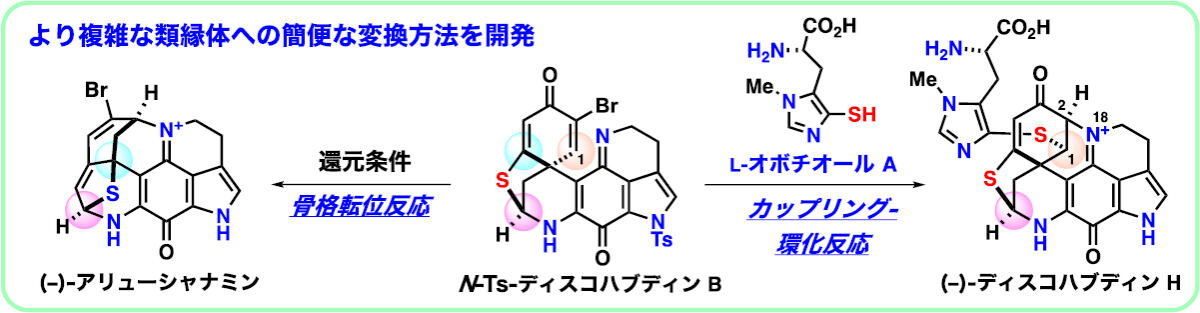
ディスコハブディンBの炭素骨格におけるC1位が酸素、硫黄、および窒素などのヘテロ原子により修飾され、さらにN18位とC2位で環構造を形成した複雑な七環性チオディスコハブディン類の効率的合成法の開発は、チオディスコハブディン類の網羅的合成に必要不可欠だ。
そこで研究チームは、類縁体の中から特に合成難易度の高い「ディスコハブディンH」を選択し、ヒスチジンのイミダゾール側鎖にチオールが導入されたアミノ酸誘導体である「L-オボチオール」と「N-Ts-ディスコハブディンB」(ディスコハブディンBの前駆体)をカップリングさせる反応を開発したとしている。
この反応は、嫌気性条件下、L-オボチオールおよびN-Ts-ディスコハブディンBの保護体を混ぜるのみという簡便な操作で進行し、ディスコハブディンHの化学合成が遂に達成されたとする。
アリューシャナミンは、2019年にLatrunculia属の海綿から単離されたばかりの、比較的新しい海洋アルカロイドだ。しかし、硫黄および窒素原子を含む極めて複雑な多環性骨格に加え、ヒト膵臓がん細胞株(PANC-1)に対して強力な抗腫瘍活性を示すことから、がんの中でも治療満足度の低い膵臓がんに対する抗がん剤のリードとして注目を集めているという。今回、そのアリューシャナミンがディスコハブディンBの骨格転位により得られる生合成仮説にヒントを得て、N-Ts-ディスコハブディンBから、わずか2段階の化学変換によりアリューシャナミンへ至る合成経路の開拓に成功したとのことだ。
研究チームは今回の研究成果について、過去数十年間合成困難だったチオディスコハブディンの4種の化学合成に成功し、その網羅的化学合成の足がかりとなるものだとする。そしてこれは、生合成経路の解明や合成による構造決定などの天然物化学分野における学術的波及効果にとどまらず、これまで埋もれていたチオディスコハブディン類の合成供給を基盤として、新規抗がん剤などの画期的な医薬品シーズの発掘に貢献することが期待されるとしている。