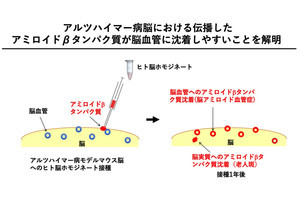
量子科学技術研究開発機構(QST)は1月17日、アルツハイマー病などの神経変性疾患の原因とされている「アミロイドタンパク質凝集体」について、細胞への毒性の強さが異なる凝集体の間には、原子運動の大きさと速さに違いがあることを明らかにしたと発表した。
同成果は、QST 量子生命・医学部門 量子生命科学研究所 構造生物学研究グループの松尾龍人主幹研究員、仏・ラウエ・ランジュヴァン研究所のアレッシオ・デ・フランチェスコ博士、仏・グルノーブル・アルプス大学のジュディス・ピーターズ教授らの国際共同研究チームによるもの。詳細は、ライフサイエンス全般を扱う学術誌「Frontiers in Molecular Biosciences」に掲載された。
アルツハイマー病では、「アミロイドβ」と呼ばれるタンパク質のアミロイド線維が脳に蓄積することで、思考や記憶の障害が生じることが知られている。また、アミロイド線維が集まってアミロイド凝集体を作ることがあり、そうしたアミロイド線維やアミロイド凝集体は合わせてアミロイドタンパク質凝集体と呼ばれている。
こうしたアミロイドタンパク質凝集体は、アルツハイマー病以外にも全身性アミロイドーシスなどでも主要因となっており、これらは「アミロイド病」または「アミロイドーシス」と呼ばれている。しかし、アミロイド病の発症メカニズムについてはまだ良く分かっていないという。
アミロイド病研究の代表的なモデルタンパク質である、ニワトリ由来のタンパク質「リゾチーム」を用いた過去の研究から、酸性条件で調製したアミロイド凝集体(凝集体A)は分散して長い線維を形成し細胞毒性が弱いこと、中性条件で調製した凝集体(凝集体N)は短い線維が塊を作り細胞毒性が強いことが知られていた。
凝集体Nが短い線維であることは、凝集体Aよりも線維が折れやすく壊れやすい性質であることが示されているとされるが、この現象を説明するため、「凝集体Nの運動が凝集体Aよりも激しい」という仮説が提案されていたものの、その真偽は不明なままであったという。
凝集体の性質が最終的には細胞毒性の発現につながるため、この仮説の真偽を明らかにすることは、アミロイド病発症メカニズムの解明における鍵になると考えられることから研究チームは今回、この仮説を検証するため、凝集体Aと凝集体Nの運動の違いを原子レベルで明らかにすることを試みることにしたという。
具体的には、凝集体Aと同Nの運動として、実験試料中の水素原子がどのように運動しているかについての調査を実施。原子の運動の大きさを解析できる弾性非干渉性中性子散乱(EINS)実験を行ったところ、凝集体Aと比べて同Nの方が、大きく運動する原子が多く含まれており、逆に小さく運動する原子の数が少ないことが判明。また、原子の運動の速さを解析できる中性子準弾性散乱(QENS)実験から、凝集体Nの原子は、同Aの原子よりも約1.6倍速く動いていることが確認されたほか、速く動く原子は、凝集体の内側ではなく外側に集まっている可能性が高いことも判明したという。これは、凝集体がほかの分子に結合したり相互作用したりするとき、直接関わる部分に原子運動の違いがあることが示されていると研究チームでは説明する。
これらの結果と、アミロイド凝集体が細胞毒性を引き起こす原因として凝集体が細胞膜に結合して膜にダメージを与えるという点、凝集体は結合しようとする部位に適した形を取る必要がある点を考慮すると、数多くの凝集体Aを含む細胞と数多くの凝集体Nを含む細胞の2種類があると仮定した場合、ある一定の時間内に、凝集体Nの方がより多く細胞膜へ結合することが可能であることから、後者の細胞では膜のダメージも起きやすくなり、最終的には細胞毒性が強くなることが考えられるとする。
-

異なる細胞毒性を示すリゾチームアミロイド凝集体。アミロイド凝集体は細胞膜に結合し、細胞膜を歪めたり破壊したりすることで細胞毒性を示し、細胞死を引き起こすと考えられている。そのため、細胞膜への結合を考える上で、凝集体の運動に関する知見が求められてきた (出所:QST Webサイト)
なお、研究チームでは、今回の研究結果により、凝集体の原子運動について大きさおよび速さの両面が明らかになったことで、今後、より複雑な現象である凝集体と細胞膜の結合の仕組みを原子レベルで解明するための道が拓けたとしており、将来的な細胞の毒性が決まるプロセス、ひいてはアミロイド病発症機構の全容解明につながるとしている。
-

(左)異なる細胞毒性を示すリゾチーム凝集体を構成する原子運動の大きさおよび速さの比較。(右)今回の研究で明らかになった、異なる細胞毒性を示すリゾチーム凝集体の運動に関する特徴の模式図。凝集体は中心部分(長方形)と外側部分(曲線)から構成される。原子運動の大きさおよび速さが、細胞毒性の強さに影響していると考えられている (出所:QST Webサイト)
また、アミロイド凝集体の特定の運動を変えるような新しい薬剤分子を設計・開発することで、アミロイド病の治療法確立に向けて、原子運動というまったく新しい視点からアプローチすることが可能になると期待されるともしている。