大阪大学(阪大)は6月14日、ヒトiPS細胞にゲノム編集技術および染色体工学を組み合わせることで、1人のダウン症候群患者から多様で詳細な疾患モデルiPS細胞を樹立し、同症の知的障害の発症に大きな役割を果たす脳内の「アストロサイト」が異常増殖するメカニズムを明らかにするとともに、その原因遺伝子として21番染色体上にある「DYRK1A」と「PIGP」の同定に成功したと発表した。
-

ヒトiPS細胞とゲノム編集技術を用いたダウン症候群の病態解析の模式図。まずダウン症新生児から採取された臍帯血を用いて、ダウン症特異的iPS細胞が作成された。このダウン症iPS細胞に、ゲノム編集技術を施すことで、多様な遺伝子改変が可能となる。このようにして得られたダウン症モデルiPS細胞パネルを、神経細胞やアストロサイトへと分化誘導することで、ダウン症における中枢神経系の病態解明を行うことが可能となる (出所:阪大Webサイト)
同成果は、阪大 医学部附属病院 総合周産期母子医療センターの川谷圭司医員、同・北畠康司准教授(小医科)を中心に、理化学研究所、奈良県立医科大学の研究者も加えた総勢13名の共同研究チームによるもの。詳細は、英科学誌「Nature」系の生物学を扱うオープンアクセスジャーナル「Communications Biology」に掲載された。
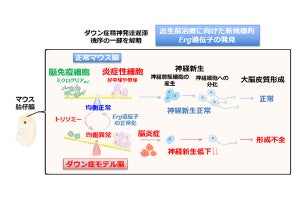
ダウン症候群は700人に1人という高頻度で見られ、近年その数はさらに増えつつあるという。知的発達障害は同症候群に見られる最も重要な合併症だが、脳のどこに問題があるのか、これまでのところよくわかっていなかったという。
ヒトの脳組織は、1000億個以上の神経細胞(ニューロン)と、その10倍以上の「グリア細胞」で構成される。そのグリア細胞の一種がアストロサイトで、中枢神経系で最も多いグリア細胞である。アストロサイトは、神経細胞に栄養を与えたり、過剰なイオンや神経伝達物質を速やかに除去したりすることにより、神経細胞の生存と働きをサポートしている。一方で、中枢神経の外傷、感染、虚血、変性疾患などのさまざまな病態において重要な役割を果たすことがわかってきており、これまで神経細胞が主役、グリア細胞は脇役と考えられてきたが、グリア細胞も重要視されるようになってきた。
また、神経細胞とグリア細胞のうちのアストロサイトの数を比較した場合、健常者の脳ではほぼ同数で構成されているが、ダウン症患者の場合、神経細胞が少なく、アストロサイトが通常の2倍以上存在することがわかってきており、そうした違いを解明することが、知的障害の理解と治療法開発につながると考えられるようになってきたという。
一方、病気のメカニズムを明らかにするには、正確な実験モデルが不可欠だ。しかし、1つの遺伝子だけが変化する単一遺伝病とは異なり、ダウン症候群では、330個もの遺伝子を持つ21番染色体が2本から3本に増えるトリソミーによって発症する。このたくさんの遺伝子のうち、いくつの、どの組み合わせの変化が、いったいどのような作用を引き起こして知的障害につながるのか、それを知ることのできる実験モデルがこれまではなかったという。
しかし、近年、iPS細胞と強力なゲノム編集技術(CRISPR-Cas9)の登場により、ダウン症の正確な疾患モデルを作り出すことが可能になってきたことから、今回の研究でも、1人のダウン症児の臍帯血から作成されたダウン症特異的iPS細胞にゲノム編集を駆使し、以下の3点の改変に成功したとする。
- 染色体を1本減らす(染色体除去)
- ダウン症重要領域だけを欠失させる(部分トリソミー)
- 染色体の遺伝子発現をトリソミーからダイソミーへと自由に変化させることができる(染色体サイレンシング)
-

iPS細胞とゲノム編集によるダウン症候群の疾患モデルiPS細胞の模式図。(a)3本ある21番染色体を1本除去することで(染色体除去)、ダイソミー細胞を樹立。(b)ダウン症重要領域と呼ばれる「4Mb」領域を欠失させ、部分トリソミーiPS細胞も樹立された。(c)ダウン症iPS細胞に、染色体不活化を引き起こす「XIST遺伝子」が挿入された。これに「ドキシサイクリン」を加えることで、自由に染色体不活化が起こる (出所:阪大Webサイト)
重要なことは、このようにして得られたiPS細胞は、すべて1人のダウン症児の細胞を基に作られたことだという。ヒトのゲノム配列は大多数が一緒ではあるものの、誰もが少しずつ異なっており(一卵性双生児を除く)、そのわずかな違いが細胞の特性に大きな変化を生じさせているため、違う個人から作成したiPS細胞を使用すると、実験結果に大きなブレが生じてしまうという懸念があった。
今回作成された多くのiPS細胞株は、基本となるゲノム配列がまったく単一であるため細胞ごとのブレが低くなる特徴がある。そのため通常なら見逃されてしまうような、わずかな変化も捉えることが可能となったという。
研究チームではこれらのiPS細胞すべてをアストロサイトへと分化誘導し、以下の2点を見出したという。
- ダウン症では、アストロサイト前駆細胞(未熟なアストロサイト)の段階で、増殖するスピードが著しく早くなる
- ダウン症アストロサイトで増殖速度が増すのは、21番染色体上のDYRK1AとPIGPの2つの遺伝子が原因である
しかも、DYRK1Aの遺伝子量を3つの対立遺伝子のうちの1つを欠失するだけで、アストロサイトの増殖が正常に戻ることも確認されたとした。
さらに、神経前駆細胞(未熟な神経細胞)では、DYRK1Aの過剰発現によって増殖が抑制されることも確認された。つまり、このDYRK1Aは遺伝子数が増えて活性が上がることで神経前駆細胞の増殖を下げ、一方でアストロサイト前駆細胞の増殖を上げるという2つの役割を持つ重要なファクターであることが判明したという。
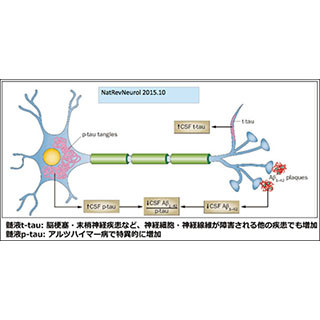
ダウン症候群は、最初の報告から約150年が経つ、古くからよく知られた疾患だ。またアストロサイトは、アルツハイマー病の発症にも重要な役割を果たしていると考えられている。
そのため、今回の研究成果により、ダウン症候群における知的発達障害の原因となるアストロサイトの異常増殖の発症機序が明らかになっただけでなく、成人期に必発する認知症のメカニズムを知る大きな一歩になると考えられると研究チームでは説明しているほか、今回の技術を活用していくことで、今後、ダウン症候群の臨床像が変化することが期待されるとしている。