東京工業大学(東工大)、東京大学(東大)、関東化学の3者は1月29日、コラーゲンビトリゲル膜を使って、ヒトiPS細胞由来の小腸前駆細胞を高効率で成熟化させ、医薬品の吸収性評価ツールなどとして活用できる小腸細胞(iPS-腸細胞)を作製することに成功したと共同で発表した。
同成果は、東工大 生命理工学院 生命理工学系の粂昭苑教授、同・白木伸明准教授、同・吉田晋平大学院生らの研究グループは、東大大学院 薬学系研究科の楠原洋之教授、同・前田和哉准教授、関東化学の渡邊輝彦研究員らの共同研究チームによるもの。詳細は、国際幹細胞学会誌「Stem Cell Reports」に掲載された。
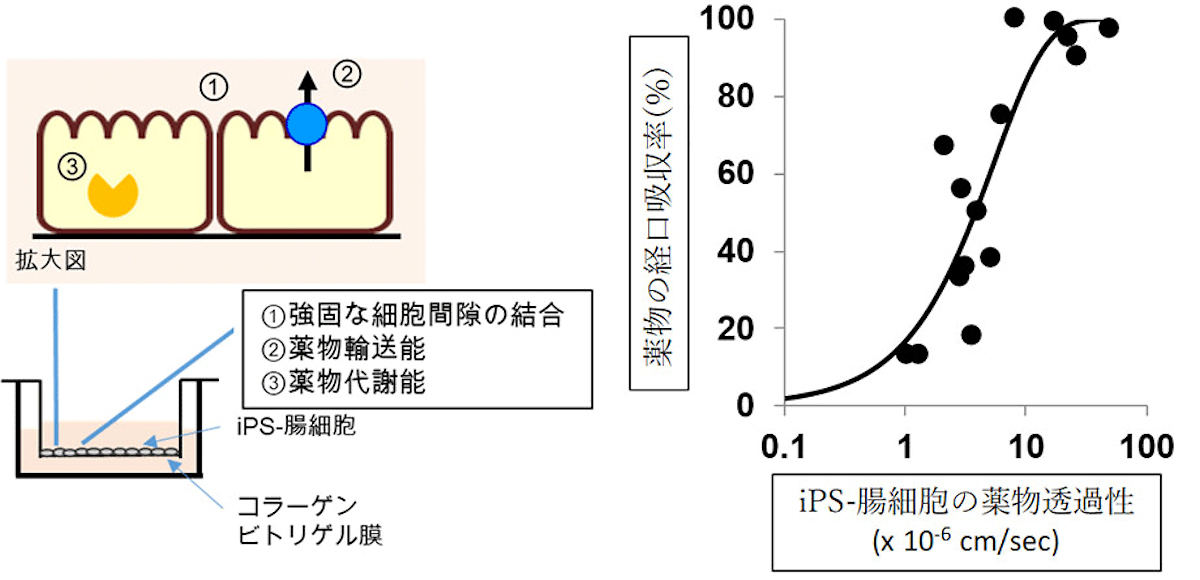
小腸は、ヒトが食事で摂取したアミノ酸や脂質などの栄養成分や水分を体内に吸収する重要な役割を担っているが、異物を体内に吸収してしまわないよう防御機構も兼ね備えている。代表的な防御機構としては、細胞間に形成された強固な細胞膜間隙の結合、細胞内に移行した分子を腸管内に再び排出する輸送能、そして異物を修飾あるいは分解する代謝能が挙げられる。
しかし、この防御機構がマイナスに働いてしまう場合もある。そのひとつが経口するタイプの医薬品だ。医薬品はいうまでもなく、可能な限り早く人体に吸収されることが望ましい。しかし防御機構は、医薬品のことも異物と認識してしまい、体内への吸収を制限されてしまうのだ。
つまり医薬品が薬効を発揮するためには小腸から効率的に吸収されることが重要となるため、医薬品は吸収性評価が行われる。現在は、ヒト結腸がん由来の「Caco-2細胞」が広く用いられているが、医薬品に対する代謝能が極めて低いことが課題となっている。そのことから、ヒトiPS細胞を小腸細胞に分化させ、吸収性評価のツール細胞にすることが期待されているのである。
ヒトiPS細胞から小腸細胞を作製する方法としては、3次元的な培養、多様な分化誘導因子の添加、分化に重要な分子の遺伝子導入といった方法が報告されている。これらに対して共同研究チームが今回目指したのは、以前からよく使われている2次元的な平面培養を用いた、より簡単な小腸細胞作製方法だ。細胞接着活性と伸展活性に優れたコラーゲンビトリゲル膜への接着培養によって、小腸前駆細胞の高効率な成熟化を促したのである。
その結果、小腸細胞マーカー分子「villin」の陽性を示す小腸細胞(iPS-腸細胞)を作製することに成功。この小腸細胞は、成熟化の指標であるアルカリフォスファターゼ活性を示したという。なお、この小腸前駆細胞はヒトiPS細胞から大量に調製し、凍結保存することも可能とした。
作製されたiPS-腸細胞の解析が行われたところ、小腸に発現する薬物輸送分子である「P-gp」と「BCRP」の遺伝子、および薬物代謝酵素である「CYP 3A4」遺伝子を発現していることが明らかになった。続いてiPS-腸細胞の機能解析結果も実施され、それらの薬物輸送分子と薬物代謝酵素が実際に基質の輸送と代謝をそれぞれ担っていることが示されたのである。
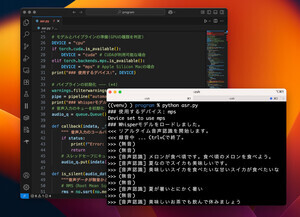
またiPS-腸細胞同士は強固に結びついていることも判明。さらに、iPS-腸細胞と薬物がインキュベートされた実験の結果、時間とともに薬物はiPS-腸細胞を透過し、その透過性は薬物の経口吸収性とよく相関することが確認された。これは、新しい医薬品の経口吸収率を、iPS-腸細胞での透過性から精度よく予測できることを意味するという。
以上の結果から、ヒトiPS細胞由来の小腸細胞は医薬品の吸収性評価ツール細胞として有用であることが明らかとなり、医薬品の開発に広く活用できると考えられるとしている。
また薬物の代謝や輸送過程において、薬物間相互作用が生じることも知られているため、さらに研究を進めることで、iPS-腸細胞を薬物相互作用の予測に活用できる可能性があるとしている。