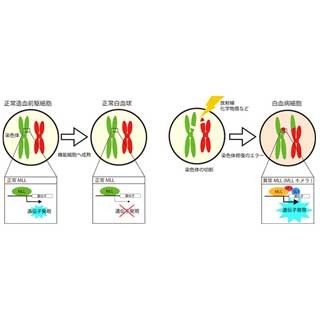
国立がん研究センター(国立がん研)は12月9日、肺小細胞がんや悪性リンパ腫などさまざまながんで不活性化変異がみられるCBP遺伝子について、p300遺伝子と相互に補い合い機能する関係があり、両方の遺伝子が機能しなくなるとがん細胞が死滅する「合成致死」の関係にあることを発見し、そのメカニズムを解明したと発表した。
同成果は、同研究センター研究所 ゲノム生物学研究分野 河野隆志 分野長、荻原秀明 研究員と、第一三共との研究グループによるもので、11月24日付けの米科学誌「Cancer Discovery」オンライン版に掲載された。
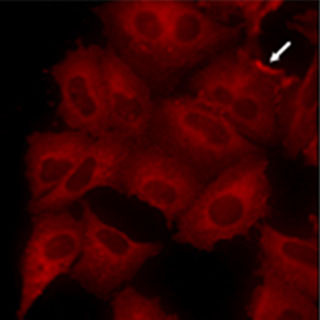
同研究グループは、CBPタンパク質とp300タンパク質の両方がなくなると、細胞の生存に必要なMYCタンパク質の発現がなくなってしまい、細胞死に至ることを突き止めた。
CBPタンパク質とp300タンパク質は、染色体を構成するヒストンタンパク質をアセチル化する酵素であり、アセチル化は、がん細胞を含めたすべての細胞が生きていくために必要な反応となっている。そこで同研究グループらは、p300タンパク質の機能を阻害する薬剤を用いることで、CBP変異がん細胞を効率よく細胞死に導くことができると考えた。つまり、p300タンパク質の機能を阻害する薬剤が抗がん剤の候補であるとしている。
今回の治療法の提案は、CBP遺伝子とp300遺伝子が、その両方が失われると細胞は生きていけないという「合成致死」の関係に基づいたもの。同分野ではこれまでも、肺腺がんに対して別の染色体制御遺伝子であるBRG1/SMARCA4について、合成致死に基づく治療法を見出し、抗がん剤の開発を進めている。