東京医科歯科大学(TMDU)は、アルツハイマー病モデルマウスおよびアルツハイマー病患者脳のたんぱく質を網羅的に解析した結果、発症前さらには老人班と呼ばれる異常たんぱく質凝集が開始する前に、たんぱく質リン酸化シグナルの異常が超早期病態として存在することを発見したと発表した。
同成果は、同大 難治疾患研究所/脳統合機能研究センター・神経病理学分野の岡澤均 教授らによるもの。詳細は国際科学誌「Human Molecular Genetics」オンライン版に掲載された。
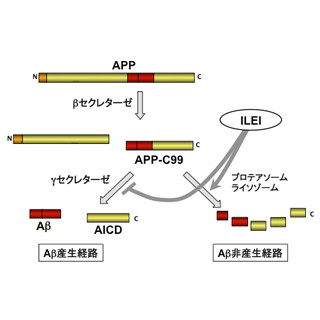
アルツハイマー病の治療方法の開発に向け、2000年代以降、アミロイドβ(Aβ)の脳内凝集メカニズムをターゲットとする主として2つの治療法が考案され、臨床試験が行われている。その1つはAβに対する抗体を体内に投与し、Aβが脳内に凝集しても脳組織に老人斑が形成されることを抑制しようというものだが、複数の研究が、抗体により老人斑が消失していたにもかかわらず、症状の改善が認められなかったという報告を行っていた。
もう1つの方法は、Aβを産生する酵素「ガンマセレクターゼ」の阻害を行う薬剤を適用させるというものだが、こちらは臨床試験の結果、副作用の問題から開発が中止されていた。
こうした背景から、現在、アルツハイマー病の研究としては、発症前あるいはAβの凝集前の超早期病態の解明と、それに介入することで治療が可能であることを示すことに注力がなされている。
今回の研究では、アルツハイマー病モデルマウス4種類とアルツハイマー病患者の死後脳を対象にプロテオーム解析を実施したほか、東京大学ゲノム解析センターの宮野悟 教授と共同でそのデータの詳細な解析を実施。さらに、そうして得られたデータから導かれたコア分子を標的として、モデルマウスによる治療実験を行い、シナプスレベルの改善状況を調べたという。
その結果、モデルマウスの種類を超えて、共通する異常リン酸化シグナルネットワーク(コア病態ネットワーク)を構成するたんぱく質(コア病態たんぱく質)は17種類に集約しており、その大半が直接的に結合していることが判明した。また、コア病態たんぱく質の大半が、死後脳でも変化が認められたほか、アミロイド病態の下流に位置づけられるタウ病態を反映すると考えられる変異型タウたんぱく質を持つトランスジェニックマウスでの解析においても同様の変化が認められたとのことで、超早期から晩期に至るまでの持続的な異常シグナルであること、ならびにモデルマウスのみならずヒト病態にもトランスレータブルな変化であること、アミロイド病態とタウ病態をつなぐ変化であることなどの可能性が示唆されたとする。
さらに、もっとも症状が重篤なモデルマウス(アミロイドの凝集(老人斑)の形成が認められるのが3カ月齢から、記憶力低下などの行動異常が検出されるのが6カ月齢以降)では、今回判明したコア病態ネットワークの変化が、発症前かつアミロイド凝集前であり、大脳皮質において興奮性シナプス後部の構造である「スパイン」が減少していることが確認されたことから、コア病態ネットワークの中でもっとも早期からリン酸化が変化するコア病態分子でリン酸化酵素(protein kinase C:PKC)の基質である「MARCKS」に対し、PKC阻害剤を投与したところ、スパインの現象が回復していることを確認。また、MARCKSの産生を減少させたところ、スパイン減少が回復していることも示されたという。
今回の結果について研究グループは、アルツハイマー病の発症前、凝集前の超早期病態の一端を捉えた成果と言えるとしており、今後、超早期のコア病態シグナルネットワークあるいはコア病態分子をターゲットとする治療法を本格的に開発することでアルツハイマー病の進行を抑制し、治癒に導く治療法を開発できる可能性がでてきたと説明している。