京都大学、岐阜大学、科学技術振興機構(JST)は5月5日、疾病の指標(バイオマーカー)となる複雑な生体分子を識別して溶けるゲル状物質「反応性超分子ヒドロゲル」の開発に成功したと共同で発表した。
成果は、京大大学院 工学研究科の浜地格 教授、岐阜大 工学部 化学・生命工学科の池田将 准教授(前・京大大学院 工学研究科助教)らの共同研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は現地時間5月4日付けで英科学誌「Nature Chemistry」オンライン速報版に掲載された。
水を媒体とするヒドロゲルはその生体適合性の高さから、診断材料、薬物放出担体、細胞培養基材など、さまざまな医療応用が期待される魅力的な材料とされている。ヒドロゲルが特定の分子の存在やその量を識別して溶けたり、再度固まったりできれば、高度な機能を持つ新しい医療材料の開発につながると期待されているところだ。
しかし、これまでに開発されたヒドロゲルが識別できる分子は、構造が単純なものに限定されていた。また、識別の対象となる標的分子ごとに新たなゲル化剤の設計と開発が求められ、その都度多大な労力を必要としているという大きな課題もあったのである。さらに、複数の標的分子が同時に存在するかどうかを見分けるヒドロゲルの開発に関しては、その設計指針さえなかったという具合だ。
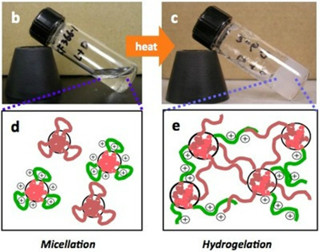
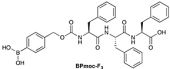
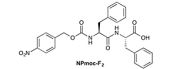
そこで研究チームは今回、小分子化合物が自律的に構造を作り出す「自己組織化」現象によってナノサイズ(1nm=100万分の1mm)の構造体を開発。そして、その機能化に取り組んだ。特に、水中でナノサイズの極細繊維(ナノファイバー)となり、それらが絡み合うことでヒドロゲル(超分子ヒドロゲル)を形成する小分子化合物(ゲル化剤)の高機能化を進展させ、非常に低濃度でゲル化する化合物の開発に成功してきたのである。今回、それらの知見を基に、酸化反応あるいは還元反応によって溶けるという特徴を持った「反応性超分子ヒドロゲル」の「BPmoc-F3」と「NPmoc-F2」が開発された(画像1~5)。
|
|
|
|
ゲル化剤の分子構造と自己組織化および化学反応の模式図。画像1(左):酸化反応に応答するゲル化剤のBPmoc-F3の分子構造。画像2(中):還元反応に応答するゲル化剤のNPmoc-F2の分子構造。画像3(右):BPmoc-F3の自己組織化および過酸化水素に応答した酸化反応の模式図 |
||
|

|
|
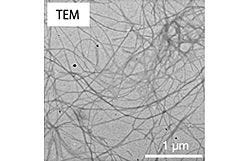
BPmoc-F3が形成するナノファイバーの顕微鏡写真。画像4(左)が透過型電子顕微鏡(TEM)写真で、画像5(右)が共焦点レーザ走査型顕微鏡(CLSM)写真 |
|
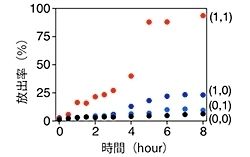
BPmoc-F3に関して確認された特徴の1つが、活性酸素種(ROS)の中で過酸化水素を選択的に見分けて溶けるというものだ(画像6)。過酸化水素は、各種「オキシダーゼ(酸化酵素)」がその基質を酸化する時に生成することが知られている。そこで、BPmoc-F3が形成するヒドロゲルにさまざまなオキシダーゼを埋め込んだところ、内包したオキシダーゼの基質をヒドロゲルに添加した時にのみゲルが溶けることが見出されたのである(画像7)。
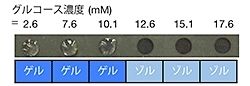
例えば、「グルコースオキシダーゼ(GOx)」を内包させたヒドロゲルは、糖尿病のバイオマーカーである「グルコース(ブドウ糖)」のみに応答して溶け(画像7の1列目)、「サルコシンオキシダーゼ(SOx)」を内包させたヒドロゲルは、前立腺がんのバイオマーカーである「サルコシン」のみに応答して溶ける(画像7の2列目)ことが実証された。
この結果は、ヒドロゲルの中でオキシダーゼが十分にその活性を保持し、基質を酸化する際生成した過酸化水素がヒドロゲルを溶かしているということを意味しているとする(画像8)。つまり、1種類のゲル化剤が形成するヒドロゲルに酵素を選んで混合するだけで、グルコース、サルコシン、痛風のバイオマーカーの「尿酸」、コリンなど、さまざまな生体分子に応答して溶けるヒドロゲルが作製できることになるというわけだ。このように多様な生体分子を見分けることのできるヒドロゲルはほかに類を見ないという。
さらに、ヒト血漿を用いた実験では、高血糖症に対応する濃度のグルコースが存在する時だけ溶けるヒドロゲルも作製可能であることが実証されており(画像9)、今後、診断材料の開発などの医療応用に幅広い貢献が期待できるとしている。
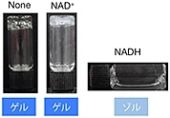
還元反応によって溶けるヒドロゲルを形成するNPmoc-F2については、「フラビンモノヌクレオチド(FMN)」を補因子とし、ニトロ基を還元する「ニトロ還元酵素(NR)」を内包させておくことで、「還元型ニコチンアミドアデニンジヌクレオチド(NADH)」の存在を選択的に見分けることが明らかにされた(画像10)。
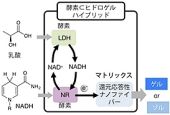
NADHは、「NAD依存性酵素」が基質を酸化する際に「酸化型ニコチンアミドアデニンジヌクレオチド(NAD+)」から再生されることが知られている。そこで研究チームは、NAD依存性酵素の1つである「乳酸脱水素酵素(LDH)」とNAD+とNRを、NPmoc-F2が形成するヒドロゲルに同時に内包させた。すると、乳酸を添加した時にヒドロゲルが溶けることが見出されたのである(画像11)。
この結果は、ゲルの中で乳酸がLDHによって酸化され、その際NAD+から再生されたNADHがゲル化剤と反応し、ヒドロゲルを溶かしていることを示しているという(画像12)。ちなみに乳酸はがん組織周辺で濃度が上昇することが知られている。
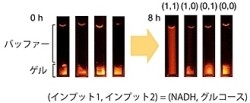
さらに、上記の2種類のゲル化剤および数種類の酵素を混合したヒドロゲルは、それぞれが識別する生体分子が同時に存在する時のみに溶けることも実証したという。すなわち、グルコースのみ、あるいは、NADHのみでは溶けず、グルコースとNADHが両方存在する時においてのみ溶ける自律応答型のヒドロゲルの開発に成功したというわけだ(画像13・14)。また、そのヒドロゲルに蛍光色素を修飾した抗体(IgG)を閉じ込めておくと、グルコースとNADHが両方存在する時においてのみ抗体を放出することも確認された(画像15・16)。
今回開発されたヒドロゲルは、水とゲル化剤と酵素を混ぜるだけで簡単に作製することが可能な点が大きな長所だ。さらに抗体のようなバイオ医薬品をそのヒドロゲルの中に閉じ込めておき、バイオマーカーの存在を識別し放出させることも可能である。
このように、化学反応の特異性を組み込んだ小分子化合物からボトムアッププロセスで作成したナノファイバーからなるヒドロゲルと酵素反応を組み合わせる手法は広く一般化することが可能であり、診断材料、薬物放出材料、再生医療用細胞培養基材など、さまざまな医療材料に「これまでにない自律的に考えて応答するという新たな機能」を付与できると期待されるとしている。