理化学研究所(理研)は11月5日、酵母を使い、細胞小器官「ゴルジ体」でのタンパク質輸送を制御する分子機構の一端を解明したと発表した。
成果は、理研 光量子工学研究領域 ライブセル分子イメージング研究チームの中野明彦チームリーダー、同・須田恭之研究員らの研究チームによるもの。研究の詳細な内容は、11月5日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
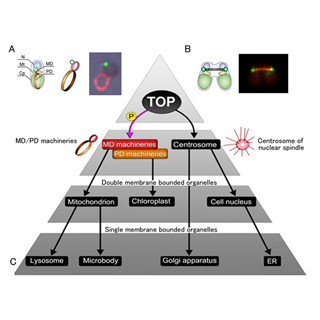
細胞は、いうまでもなく地球の全生物の構造上・機能上の基本単位だ。その中には、細胞小器官と呼ばれるさまざまな構造体がある。ゴルジ体は真核生物における細胞小器官の1つで、新たに作られたタンパク質(積み荷タンパク質)を受け取り、糖鎖付加などの修飾を施し、仕分けして適切な場所へと正しく輸送する役目を担う。
ヒトなどを含む高等動植物のゴルジ体は平らな袋状の槽が積み重なった層板(スタック)構造を示す(ただし、出芽酵母ではスタック構造を示さず、各々の槽が細胞内に散在している)。そのスタック構造の層の内、積み荷タンパク質を受け取る側を「シス槽」、積み荷タンパク質が仕分けされ出ていく側を「トランス槽」、その中間を「メディアル槽」という。それぞれの槽は、糖鎖修飾酵素や「SNAREタンパク質」など、膜の性質や局在する酵素群「レジデントタンパク質」が異なることがわかっている。
そしてゴルジ体内の積み荷タンパク質の輸送については、過去に小胞輸送モデルと槽成熟モデルの2つが提唱されていた。研究チームは、出芽酵母を用いてゴルジ体内の輸送モデルの解明に取り組んでおり、2006年には高速高感度の「レーザー共焦点顕微鏡システム」によるライブイメージングにより、シス槽が徐々にその性質をメディアル槽、トランス槽へと変えていく様子をとらえることに成功している。つまり、ゴルジ体内の輸送は槽が時間と共にその性質を変えていく槽成熟によることを示したというわけだ。しかし、現在でもゴルジ体内における積み荷タンパク質の輸送については論争が絶えず、ゴルジ体の成熟を司る分子機構の解明が望まれてたのである。
細胞内で行われている膜構造によるタンパク質の輸送経路(膜交通)を制御している分子の1つに「Rab GTPアーゼ」がある。Rab GTPアーゼはRasスーパーファミリーに属する「低分子量GTPアーゼ(GTP結合タンパク質)」で、「GTP/GDP交換因子」とGTPアーゼ活性化タンパク質によって活性化型、不活性型に交互に変換される「分子スイッチ」としての機能を持つ(画像1)。活性化すると標的膜上でさまざまな膜交通を制御し、不活性化すると膜から細胞質中へと分散し、次の活性化に備えるのである。
酵母のゴルジ体には、「Ypt1」、「Ypt6」、「Ypt31」、「Ypt32」の4種類のRab GTPアーゼが存在し、ゴルジ体特有の膜交通を制御していることが知られていた。しかし、成熟に伴いその性質を時々刻々と変えていくゴルジ体の各槽においてどのように時間的・空間的に制御されているか、直接的には解明されていなかった。そこで研究チームは、ゴルジ体に存在するRab GTPアーゼの挙動を、独自に開発した「高感度共焦点顕微鏡システム(SCLIM)」によってライブイメージングし、Rab GTPアーゼの制御機構の解明に取り組んだのである。
まず研究チームは、3種のRab GTPアーゼとゴルジ体の各槽に局在するレジデントタンパク質を異なる蛍光タンパク質で標識し、それぞれのRab GTPアーゼがどの槽に局在するかを調べることからスタート。その結果、細胞小器官「エンドソーム」からゴルジ体への膜交通を制御するYpt6がトランス槽に局在する割合は低く、主にシス槽からメディアル槽に局在すること、多様な機能を持つYpt32は、Ypt6とは逆にトランス槽に局在することが判明した。
また、Ypt6の挙動をライブイメージングで詳細に解析したところ、ゴルジ体が成熟するにつれてYpt6はゴルジ体の各膜上から徐々に消失し、逆にYpt32は徐々に蓄積しているのが確かめられたのである。この結果から、Ypt6とYpt32はゴルジ体の各膜上で相互排他的に存在することがわかった(画像2・3)。
2種のRab GTPアーゼの相互排他的な局在の制御には、近年提唱されている「Rab GAPカスケード」と呼ばれるRab GTPアーゼの転換制御機構が関与していることが考えられるという。酵母にはRab GTPアーゼを不活性化型に変換するタンパク質「GAP(GTPアーゼ Activating Protein)」が8種類存在する。そこで、それぞれの変異株を作製し、Ypt6とYpt32の局在が解析された。その結果、GAPの1つであるGyp6を産生しないgyp6破壊株だけにYpt6とYpt32が同時に局在していたのである。
画像4が、その野生株とgyp6変異株におけるYpt6(緑)とYpt32(マゼンタ)の局在をとらえた画像だ。野生株でそれぞれの蛍光シグナルは共局在しないが、gyp6変異株では矢じりで示されているように共局在が見られた。点線は酵母細胞の形を示している。
また、遺伝学的、生化学的解析により、Gyp6は活性化したYpt32が結合してゴルジ体膜上に局在し、そのGyp6がYpt6を不活性化し細胞質中に分散させていた。この分子機構により、Ypt6とYpt32は、ゴルジ体の膜上で相互排他的に存在することが判明。これはゴルジ体の成熟に伴い、Rab GAPカスケードによりYpt6が膜上から徐々に消失し、Ypt32が徐々に蓄積することで、それぞれが制御する膜交通が転換することを示している(画像5)。
|
|
|
|
画像4(左):野生株とgyp6変異株におけるYpt6とYpt32の局在。画像5(右):Rab GAPカスケードによるYpt6からYpt32への転換。図の上はゴルジ体の成熟と同調したYpt6からYpt32への転換を示している |
|
一方で、Rab GTPアーゼがゴルジ体の各膜の性質を規定すると考えられていることから、続いてRab GAPカスケードにおけるゴルジ体の槽成熟への寄与が調べられた。具体的には、Rab GAPカスケードが機能せず、複数のRab GTPアーゼがゴルジ体の同じ膜上に共に存在する変異株が作製され、ゴルジ体の槽が成熟する時間が計測されたのである。その結果、変異株においても槽成熟は進むものの、野生株と比べて遅延が見られ、ゴルジ体の機能にも影響があることが確認された。これらの結果は、Rab GAPカスケードがゴルジ体の槽成熟に少なからず寄与していることを示しているという。
今回明らかになったタンパク質輸送に関わる分子機構は、ゴルジ体の槽成熟を司る分子機構全体の一端だ。今回の研究で明らかになったRab GTPアーゼを初めとする膜交通を制御する分子群や、ゴルジ体の膜の組成などさまざまな因子が協調して成し遂げられていると考えられるという。
ゴルジ体は細胞内膜交通において、輸送すべき積み荷タンパク質が正確に運ばれるために行き先ラベルを正確に貼り、仕分け分別する配送センターとしての機能を果たしている。このような分子機構を1つ1つ解明することで、ゴルジ体の機能の全容が明らかになることが期待できるとした。
また、ゴルジ体における輸送システムの破綻は高等生物では細胞、組織そして生態の恒常性維持に深刻な影響を及ぼす。真核生物のモデルとして長年研究が続けられる酵母を使って細胞の基本的なメカニズムを理解することが、ヒトや植物を初めとする多細胞生物の生体の理解へとつながるとしている。
今回の研究で開発、使用した顕微鏡システムは超解像技術の中でもライブイメージングに適しており、マルチカラーによるイメージングも可能になりつつあるという。これらの技術を駆使することにより、今までに明らかにできなかった謎を解くことができると確信しているとした。








![志布志市、事故対応の要諦は「被害者に寄り添う」こと [事故対応アワード受賞]](/techplus/article/20240617-secraward-shibushi/index_images/index.jpg/iapp)