理化学研究所(理研)は5月1日、タンパク質の折り畳みを助ける「分子シャペロン」の1つ「ヒト型プレフォルディン(PFD)」が、アルツハイマー病の原因とされる「アミロイドβ」の凝集を抑制し、低毒性化していることをマウスを用いた実験で発見したと発表した。
成果は、理研 基幹研究所(当時)前田バイオ工学研究室のカリン・ソルヤードゥ国際特別研究員(現・理研 脳科学総合研究センター 神経タンパク制御研究チーム研究員)、同・座古保専任研究員、同・前田瑞夫主任研究員、理研 脳科学総合研究センター 疾患メカニズムコア神経タンパク制御研究チームの西道隆臣シニアチームリーダー、カナダ・サイモンフレーザー大学のミシェル ルー教授らの国際共同研究チームによるもの。研究の詳細な内容は、近日中に米科学雑誌「Biochemistry」に掲載される予定だ。
アルツハイマー病は、発症すると記憶障害や学習障害などが生じ、生活に支障を来す。さらに重症になると、寝たきりになってしまう。発症の主な原因は、タンパク質のアミロイドβが脳内において凝集・蓄積することと考えられており、それを抑制することが有効な治療法になると予想されている。
アミロイドβはアルツハイマー病患者に特徴的な脳内老人班の構成成分である約40残基からなるペプチド断片だ。凝集しやすく、不溶性のアミロイド線維を形成するほか、「可溶性オリゴマー(重合体)」を形成する。ちなみに可溶性オリゴマーとは、超遠心により沈殿せず、電気泳動ゲル内で分析可能なサイズ(約1000kDa以下)の重合体のことだ。
アミロイドβがアルツハイマー病の主要因と前述したが、近年の研究から、アミロイドβが形成する毒性の高い可溶性オリゴマーが病気の主因であること、つまりアミロイドβという犯罪グループの中の主犯格である可能性が高くなってきたとされている。
また、タンパク質の構造形成、つまり正常に働くために正しく折り畳まれるために重要な役割を持つタンパク質の分子シャペロンは、変性し構造が壊れたタンパク質の凝集を抑制する働きを持ち、活性制御に関与することも知られていた。
古細菌や真核生物に存在するプレフォルディン(PFD)はそうした分子シャペロンの1種だ。研究チームは、PFDが何らかの原因で変性したタンパク質の凝集を抑制する機能が特に強いことに注目し、これまでその分子機構を解析してきた。
PFDはクラゲのような特徴的な構造を有しており、新生タンパク質・変性タンパク質に結合して凝集を防ぐと共に、別の分子シャペロンの「シャペロニン」に基質タンパク質を受け渡し、協調的にタンパク質が正しく立体構造に折り畳まれることを助ける役割を担う。ヒトにもPFDは存在し、ヒト型PFDは異なるアミノ酸配列を持つ6つのサブユニットで構成されている。
PFDはアミロイドβのような病因となる凝集性タンパク質にも作用することが予想されるが、ヒト型PFDがアミロイドβの凝集に対してどのような働きをするかについては不明だったのである。
そこで研究チームは、アルツハイマー病とPFDの関係を調べるために、アルツハイマー病モデルマウスの脳内においてPFD発現の調査を行った。アルツハイマー病モデルマウスは、「アミロイド前駆体タンパク質(APP)遺伝子」を染色体上の不特定部位に挿入し、マウス脳内でAPPを過剰に発現させることで、結果的にアミロイドβが蓄積するようになる遺伝子改変マウスである。
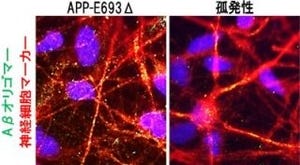
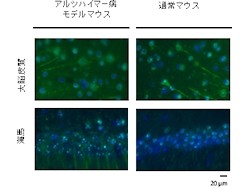
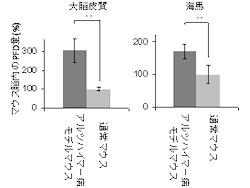
加齢と共に学習・記憶能力などの認知機能に障害を示す。このモデルマウスを用いて調査した結果、通常マウスより多くのPFDが発現していることが見出された(画像1・2)。これは、PFDがアルツハイマー病に関係していることを示しているという。
|
|
|
アルツハイマー病モデルマウスと通常マウスにおけるPFD発現量の比較。画像1(左):マウス脳切片(大脳皮質と海馬)の抗体染色像。緑はPFD、青は細胞核を示している。左がアルツハイマー病モデルマウスで、右が通常マウスで、共にPFDが確認された。画像2(右):ウェスタンブロッティング法で、脳抽出物のPFD発現量を比較したグラフ。通常マウスを100%とした相対量が示されている |
|
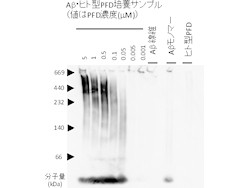
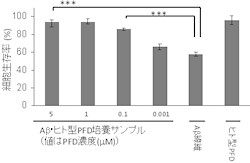
次に、PFDがアミロイドβへ及ぼす影響を調べるため、研究チームは大腸菌で作製したヒト型PFDとアミロイドβを試験管内で培養。すると、アミロイドβの凝集は抑制され、可溶性オリゴマーが形成されることが発見された(画像2)。また、この可溶性オリゴマーの細胞に対する毒性を「MTT法」で評価したところ、通常見られるアミロイドβ線維凝集体より毒性が低いことがわかったのである(画像3)。
なおMTT法とは、「3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT)」を用いた細胞の生死判定法。MTTは黄色であるが、細胞が生きていればミトコンドリアでの還元反応によりMTTは還元され、紫色の色素に変わる。生じた色素量を550nmの吸光度により定量し、細胞の生存率を決定する仕組みだ。細胞毒性の評価によく用いられている。
画像3は、ヒト型PFDにより形成したアミロイドβの可溶性オリゴマーの分子量評価。さまざまな濃度のヒト型PFDとアミロイドβを培養したサンプルから、電気泳動で可溶性オリゴマーを大きさ別に分離したものだ。その後、「ウェスタンブロット法」でアミロイドβを染色して分子量が調べられた結果、高分子量(300~700kDa)の可溶性オリゴマーが検出された。
画像は、ヒト型PFDにより形成された可溶性オリゴマーの細胞毒性の評価。さまざまな濃度のヒト型PFDとアミロイドβを培養したサンプルから形成された可溶性オリゴマーの細胞毒性をMTT法で評価したものである。評価の結果、ヒト型PFD量が多いほど細胞生存率が高いことが判明。つまり、ヒト型PFDによりアミロイドβから毒性が低い可溶性オリゴマーが形成されることがわかったというわけだ。
研究チームは、これらの結果から、PFDがアミロイドβ凝集の抑制や毒性の低減で重要な役割を果たしているとした。アミロイドβが形成する可溶性オリゴマーの高い毒性が病因になるとされつつあることを前述したが、その一方で毒性の低い場合も見つかっており、実はこれまで可溶性オリゴマーの毒性の由来は謎だった。
そこで、今回見出した毒性が低い可溶性オリゴマーと、毒性が高く分子量はほぼ同じ可溶性オリゴマーとを比較したところ、抗体による認識のされ方が異なっていることが判明したというわけだ。この結果は表面構造が異なることを示唆しており、オリゴマーの表面構造が毒性のカギである可能性が高いこともわかったのである。
こうしたことを受けて研究チームは、今後、生体内でのPFDの働きをさらに詳しく解明できれば、アルツハイマー病の新しい治療法開発が期待できるとした。