京都大学(京大) iPS細胞研究所(CiRA)は4月24日、ヒトiPS細胞から、従来手法に比べ短期間で筋肉細胞を高効率/高再現性で作製することに成功したと発表した。
同成果は同大CiRAの櫻井英俊 講師、名古屋大学医学系研究科の田中章仁 大学院生(CiRAにて学外研究)らによるもの。詳細は4月23日(米国時間)付けでオンライン科学誌「PLOS ONE」に掲載された。
すでにヒトiPS細胞やES(胚性幹)細胞から筋肉細胞を作製する試みは各所にて進められてきたが、効率が低いことに加え再現性も低く、同じ手法を用いても、細胞株が変わると筋肉細胞の出来具合が変わってしまうという課題があった。
そこで研究グループは今回、こうした課題の解決に向け、新たな骨格筋の分化誘導法開発に挑んだという。
具体的には、テトラサイクリン系抗生物質の一種で細菌のタンパク質合成を阻害する働きがある「Doxycycline」に反応して目的の遺伝子を働かせることのできるベクター(遺伝子の運び屋)に、細胞の運命を骨格筋へと変えることのできる骨格筋分化制御因子「MyoD1」を組み込み、iPS細胞へと導入し、MyoD1を働かせている細胞集団を選択したほか、骨格筋へと分化誘導するための培養条件の検討を実施し、筋肉や骨、心臓、腎臓、真皮などを生み出す細胞集団「中胚葉」を経ずに骨格筋細胞を約90%近くの効率で再現性よく得る方法を発見した。
|
|
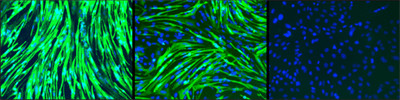
ヒトiPS細胞から分化させた骨格筋細胞の9日目の写真(左から「健康な方のiPS細胞由来」「三好型ジストロフィー患者由来」「分化誘導なし」の写真)。分化誘導によって、左と真ん中の写真で緑色に光る筋肉細胞を確認することに成功。緑色が骨格筋細胞によくみられるミオシン重鎖、青色が細胞核となっている |
実際の研究では、骨格筋細胞が生じていることを確認するために、細胞どうしが融合するか、電気刺激により収縮するかなど、さまざまな方法で解析したところ、骨格筋細胞の分化誘導に必要な時間がこれまでの4~6週間から、2週間以内へと短縮できることが確認されたという。
また、この成果を受ける形で、実際に骨格筋細胞の細胞膜が壊れやすくなるという症状がみられやすい三好型筋ジストロフィー患者の協力を得てiPS細胞株を2つ作製し、骨格筋細胞へと分化誘導させ、このiPS細胞由来骨格筋細胞の細胞膜の一点にレーザーをあて、細胞膜に穴を開けたところ、健康な人に比べ、修復のスピードが遅くなることが確認されたという。
さらに、三好型筋ジストロフィー患者では膜タンパク質「ジスフェリン」が欠損していることが知られていることから、過剰に細胞内でジスフェリン遺伝子を働かせたところ、膜修復機能が回復することも確認されたという。
なお、今回の成果は、三好型筋ジストロフィーの病態をシャーレ上で再現することに成功したもので、iPS細胞を用いた筋疾患の病態再現は、世界で初めての成果だという。そのため研究グループでは今後、今回の成果を三好型筋ジストロフィーに対する創薬スクリーニングへ発展させるとともに、骨格筋細胞の分化誘導法を他の難治性筋疾患に用いることで、多くの筋疾患に対する新たな治療法の開発、創薬につなげていきたいとの期待を示している。