東京大学生産技術研究所(東大生産研)は5月21日、ウイルスとバクテリアの「重複感染」によって重篤な症状が引き起こされる分子機構の1つを解明したと発表した。
成果は、東大生産研・分子免疫学分野の根岸英雄特任助教、柳井秀元特任助教らの研究グループによるもの。JST課題達成型基礎研究の一環として研究が行われた。研究の詳細な内容は、英国時間5月20日付けで英科学誌「Nature Immunology」オンライン速報版に掲載された。
ウイルスとバクテリアの重複感染は、それぞれの病原体の単独の感染と比較してより重篤な症状を引き起こすことが広く知られており、重複感染症として臨床的にも重要な疾患となっている。ただし、なぜそのような重複感染が症状を重篤化させるのかという分子機構については、これまでよくわかっていなかった。
このような重複感染症は、呼吸器系のウイルス感染時に起こることから、インフルエンザなどいくつかのウイルス種については、そのウイルスが持つ特性として、抗バクテリア応答を抑える機構が存在するという報告もある。
しかし、当然このような機構は特定のウイルス種に限られたものであり、それ以外のさまざまなウイルス/バクテリアの組み合わせで引き起こされる、多様な重複感染症の背後にあるメカニズムを説明できるものではなかった。
また、今までの重複感染症の解析の焦点は主に病原体の性質であり、宿主の免疫応答、特に自然免疫応答のシグナル経路に主眼をおいた解析はほとんどなかったのも、解明が進んでいなかった要因の1つである。
感染に対する生体防御の仕組みは、さまざまな病原体認識受容体のシグナル経路が調べられて来た。ウイルス感染に対抗する受容体経路の1つとして「RLR経路(RIG-I様受容体経路:ウイルスなどに由来する核酸を認識して自然免疫系を活性化させる受容体)」を介して、転写因子「IRF3」が活性化され、主に「I型IFN」を誘導してウイルス感染からの生体防御に関与していることがわかっていた。
また、バクテリア感染時は「TLR経路(Toll様受容体経路:種々の病原体を認識して自然免疫系を活性化させる受容体経路)」がバクテリア感染からの生体防御に重要な役割を果たしていることも確認されている。
しかし、RLR経路とTLR経路において引き起こされる免疫応答の違いやその詳細な仕組み、さらに、重複感染の際に互いの経路がどう影響し合っているかは未解明だった。
今回、研究グループは生体のウイルスとバクテリアに対する免疫応答に焦点を当て、発現される遺伝子と誘導される免疫応答の比較解析を実施。それにより、ウイルスとバクテリアそれぞれに対する特異的な応答を詳細に解析をしたのである。
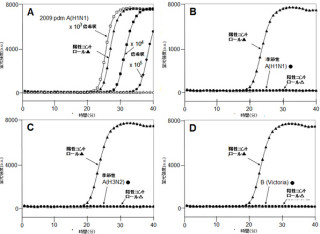
まず、ウイルス感染とバクテリア感染によって抗原提示細胞で誘導される遺伝子群に対して、網羅的に比較解析が行われた。その結果、ウイルス感染ではRLR経路を介して「I型IFN遺伝子群」が、バクテリア感染ではTLR経路を介して「IL-12p40遺伝子」が、強力かつ特異的に発現誘導されることが判明した次第だ(画像1)。
画像1は、TLR刺激とRLR刺激で誘導される遺伝子の網羅解析をまとめたグラフである。腹腔マクロファージをRLR(「B-DNA」)刺激または「TLR(CpG-B)」刺激をし、4時間後のmRNA(メッセンジャーRNA)誘導をマイクロアレイ解析によって、網羅的な比較解析を行ったものだ。ウイルスによる刺激に対してはI型IFN遺伝子群の、バクテリアによる刺激に対してはIL-12p40遺伝子の発現が顕著に誘導された。
なお、B-DNAとは「B-form DNA」の略で、ウイルス感染時に活性化するRLR経路のリガンド(特定の受容体に特異的に結合する物質のこと)として使用される。またCpG-Bとは、非メチル化CpGオリゴヌクレオチド Bタイプの略。バクテリアゲノムに多く含まれる構造で、TLR9のリガンドだ。
これらの遺伝子は、それぞれ抗ウイルス応答及び抗バクテリア応答に必須の遺伝子であり、特にIL-12p40は適応応答の方向をコントロールし、「Th1/17細胞」応答を活性化する。なお、Th1/17細胞は活性化ヘルパーT細胞だ。「Th1細胞」は細胞内の、「Th17細胞」は細胞外のバクテリアの排除に関与し、同時に自己免疫疾患の発症にも関与している。
このため、ウイルス感染またはバクテリア感染で誘導される適応免疫応答を比較すると著明な差異があり、I型IFN遺伝子群はより強く「Th2細胞」応答を誘導する一方で、IL-12p40遺伝子はTh1/17細胞応答を顕著に誘導することも判明した。なお、「Th2細胞」も活性化ヘルパーT細胞の1種。抗体タンパク質の産生やアレルギー性疾患の発症に関与する。
ウイルス/バクテリアそれぞれの感染で特異的に誘導される免疫応答が明らかとなったことから、次に研究グループは、ウイルス感染によって活性化する応答が、バクテリア感染によって活性化される応答に与える影響の解析を行った。
その結果、ウイルス感染によってRLR経路が活性化した状態では、バクテリアによって活性化するTLR経路からのIL-12p40遺伝子の発現が強く抑制されることが発見されたのである(画像2)。
さらに、この抑制機構を解析した結果、ウイルス由来の核酸で強力に活性化される「IRF3転写因子」が、IL-12p40遺伝子の発現を抑制することも発見された。IRF3を欠損した細胞では、野生型と比較してIL-12p40遺伝子の誘導が著明に増強したのである(画像2)。
画像2は、腹腔マクロファージを「TLR刺激」した時のIL-12p40遺伝子の発現と、「RLR刺激(poly(I:C))またはB-DNA)」した後、さらにTLR(LPS)刺激が行われた時のIL-12p40遺伝子の発現を「定量的RT-PCR法」により解析した(* *p<0.01)
なおpoly(I:C)とは、「polyinosine-polycytidylic acid」の略。ウイルス感染時に活性化するRLR経路のリガンドとして使用。またLPSとは「リポポリッサカライド」の略。バクテリアの細胞壁の構成成分で、TLR4のリガンドだ。
そして野生型を用いた実験では、TLR刺激するとIL-12p40遺伝子の発現が見られた。その一方で、野生型をRLR刺激した後にTLR刺激をした時はIL-12p40遺伝子の発現が抑制されたのである。
また、IRF3を欠損したマウスではIL-12p40遺伝子の誘導が増強され、RLR刺激した後にTLR刺激をした時はIL-12p40遺伝子の発現は野生型とは逆で抑制されず、より増強されることが確認された。
上記の結果から、ウイルス感染がIL-12p40遺伝子の発現を抑制して、抗バクテリア応答を抑えることが考えられたので、この仮説を生体レベルで検証するため、マウスにウイルスの1種である「VSV」(Vesicular Stomatitis Virus:水疱性口内炎ウイルス)及びバクテリアの1種である「リステリア」を重複感染させ、抗バクテリア応答の解析が実施された。
その結果、VSVを感染したマウスはIL-12p40遺伝子の発現が低下し、Th1/17細胞応答が抑制されることがわかったのである。なお、リステリアはリステリア属に属する真性細菌8種類の総称だ。今回は、「リステリア・モノサイトゲネス」が用いられた。ヒトに対する病原性を持つ。
VSVの抗バクテリア応答の抑制によって、VSV/リステリア重複感染マウスでは、リステリア単感染マウスと比較して1000倍以上にもリステリアが増殖し、著明な臓器の障害及び早期の死亡が発生したのである。
一方で、IRF3を欠損したマウスでは、重複感染時もIL-12p40の誘導が抑制されないことから、Th1/17細胞応答も正常に誘導されるため、野生型マウスよりも、著明な耐性を示し、生存率の著明な上昇及び臓器障害の低減が認められた(画像3)。
画像3は重複感染したマウス肝臓の組織学的分析。野生型またはIRF3欠損マウスにVSVを感染させてから1時間後、さらにリステリアを感染させ、4日後に肝臓を摘出し、パラフィン切片を作成後、「HE染色」を実施したVSVとリステリアが重複感染すると、野生型マウスでは激しい組織形態の破壊が起きるが、IRF3を欠損したマウスでは組織破壊が著明に低減した形だ。
なお、HE染色とはヘマトキシン・エオシン染色の略で、細胞核や細胞質を染色する技術のこと。組織形態の観察に用いられている。
今回の研究で発見した抗ウイルス応答による抗バクテリア応答の抑制機構は、宿主の免疫応答の性質がもたらす免疫応答の弱点ともいえる機構であり、少なくとも検討した範囲では、ウイルス/バクテリア側の性質に依存していない。
そのため、さまざまなウイルス/バクテリアによる重複感染症において、この機構が同じように関与している可能性がある。今後、この機構を標的とすることで、さまざまな重複感染症の治療法確立が期待できると考えている。
一方、IL-12p40が活性化するTh1/17細胞応答は自己免疫疾患を増悪することが有名だ。ウイルス感染が自己免疫疾患の病態に関与するケースも報告されているので、今回の研究において見いだされたIRF3によるIL-12p40の抑制機構は、ウイルス感染による自己免疫疾患の発症リスクを抑えるブレーキ役を果たしている可能性がある。
さらに、IL-12p40にはアレルギー疾患の増悪に関与することが報告されているTh2細胞応答を抑制する性質もあることから、今回見いだされた機構がアレルギー疾患の増悪に関与していることも考えられるという。今回の発見を礎として、アレルギーや自己免疫疾患の病態抑制についての理解が深まると期待されると、研究グループはコメントしている。