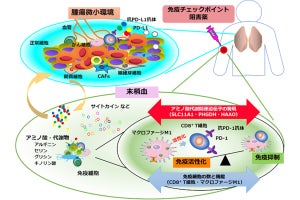
T-DM1-IR700を近赤外光照射して質量分析を行ったところ、16J/cm2の光照射でDM1の誘導体が検出され、T-DM1-IR700から光照射によりDM1誘導体が放出されることが証明された(光による薬剤放出機能)とする。同機構は、抗体を変えても同様に放出されることから、多様ながんの特異標的に対する抗体にも利用できることが確かめられたという。
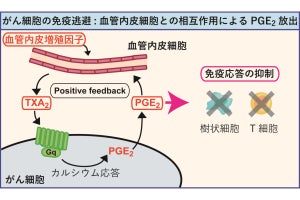
また、HER2を高発現するマウスがん細胞である「3T3/HER2」と、HER2を発現しないヒト乳がん細胞である「MDAMB468」を混ぜた、がん標的抗原不均一発現モデルを構築。それに対し、T-DM1-IR700と近赤外光線の組み合わせで、薬剤が結合していないMDAMB468細胞への抗がん効果(光バイスタンダー効果)が確認できたとする。
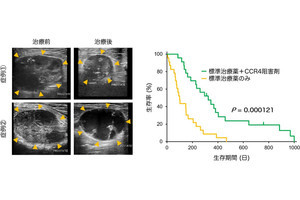
動物モデルでは生存期間の延長が見られ、中には治療した動物モデルではがんが完治したものも存在し、がんの根治を目指せる治療法であることが示唆されたという。さらには、肺がん細胞を用いた実験でも同じ結果が得られ、臓器横断的に今回の治療概念が応用できることが考えられるとした。
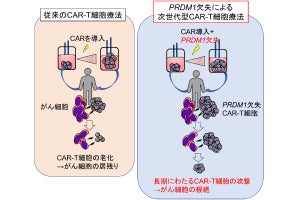
なお、今回の手法は、まず静脈投与により腫瘍に薬剤を集積させた後に腫瘍部位に近赤外光線を照射し、NIR-PITの効果により抗体で標的するがん細胞を破砕。それと同時に、光照射によって近傍へ放出される抗がん剤の作用によって、標的から漏れたがん細胞を光バイスタンダー効果で細胞死に至らしめるという仕組みだという。この2段構えによって、がんの不均一な発現に由来する治療抵抗性を克服することが可能な、新しい治療概念を創出することに成功したという。また、今回のADCは、すでにがん治療で認可されており、またNIR-PITも限定承認を受けていることから、今回の手法は臨床応用が容易と考えられるという。
研究チームでは、今回の治療は、がん特異標的抗原の不均一な発現により、再発が問題となっている固形がんへの抗体治療の概念を一歩進めるものとして、また実装されて間もないNIR-PITの効果を高める新手法として、臨床現場で将来的に使用できるようになるものと期待されるとしている。