株式投資型クラウドファンディングのイークラウドで、2021年11月6日にスタートし、開始後わずか5日の11月11日時点(本稿執筆時)で目標の2000万円を大きく上回る2720万円の申込金額を受けている注目のベンチャー企業がある。岐阜大学発の創薬企業である「e-NA Biotec」(イーエヌエイ・バイオテック)だ。同社が研究開発中の、早期膀胱がんをターゲットとした核酸医薬の一種である「マイクロRNA(miRNA)医薬」が大きな期待を集めている。
そこで、愛知工業大学工学部・教授/岐阜大学・名誉教授および同大学工学部・特任教授を兼任し、科学技術振興機構(JST)の大学発新産業創出プログラム(START)の支援を受けて、2018年にe-NA Biotecを設立した北出幸夫代表取締役に、マイクロRNA医薬とはどのようなものか、またその進展具合などを伺ってみた。
早期がんでも治療が難しい「膀胱がん」
細胞内のDNAが損傷を受けて修復がうまくいかない場合、通常ならその細胞はアポトーシス(自死)を行うことで取り除かれ、個体として問題のない状態が保たれるようになっている。しかし、何らかの理由でその仕組みがうまく働かず、細胞が異常化した状態で増殖してしまう場合がある、それが「がん」である。
ヒトはクジラやゾウなどと比べると、DNAの修復機構があまり強くはなく、がん化しやすいといえる。寿命が延びるほど、さまざまな要因によってDNAが損傷する確率が増えるため、現在、日本人は2人に1人ががんを患うとされている。
もちろん、研究者や技術者もただ指をくわえて見ているだけではない。世界中でがんに関する研究成果が日々発表され、新たな治療法や医療薬などの開発も進められている。日本国内の大学や研究機関だけを見ても、連日のごとく何かしらのがんに関する研究成果が発表される状況である。人類は、ゆっくりとではあるかもしれないが、がんを理解し、その克服に進んでいると言える。
とはいえ、残念ながら完全にがんを理解し、制圧するまでにはほど遠い。がんはできる部位によって特徴も異なるため、有効な治療方法が外科手術ぐらいしかないものもまだまだあるのだ。そうした難しいがんの1つが、膀胱内に悪性腫瘍ができる膀胱がんだ。日本国内では年間で約2万3000人(うち男性が約1万8000人)が診断され、約9000人が亡くなっている。60代以上に多い疾患で、国内ではこの30年で患者数が4倍に増えているという。
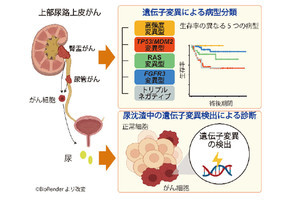
膀胱は、大別して内側から外側に向かって、粘膜上皮、粘膜下層、筋層、脂肪組織の4層構造となっており、がんの浸潤(広がり)の仕方によって診断結果が大きく2種類に分かれる。粘膜上皮表面に悪性腫瘍ができるか、もしくは浸潤したとしても粘膜下層までなら早期がんであり、膀胱がん患者の約75%がこの段階で発見される。
しかし早期に発見できたからといって、油断はできない。早期の場合、内視鏡手術とBCGの注入による治療が行われるが、残念ながらそのうちのおよそ60%でがんが再発し、結局は膀胱の全摘手術に踏み切らざるを得ない「進行がん」となってしまう。
-
(左)膀胱がんは大別して2種類あり、筋層まで広がっていなければ早期がんで、膀胱がん患者の約75%がこの段階で発見される。(右)しかし、せっかく早期段階で発見されても、そのうちの約60%のヒトでがんが再発し、進行がんとなり、膀胱の全摘手術が必要となる (出所:e-NA Biotec事業概要資料)
進行がんは、内側から3番目の筋層や最も外側の脂肪組織までがんが届いてしまっているケースをいう。進行がんになってしまうと、ほかの部位へ転位する可能性を少しでも減らすには全摘手術しかなくなる。しかも、全摘手術では単に膀胱だけを摘除するのではなく、男性なら前立腺や精のう、リンパ節(必要に応じて尿道)など、女性なら子宮や尿道、膣前壁(必要に応じて卵巣)など、隣接する臓器や器官も同時に摘除する必要がある。
さらに摘出した後も、尿の排泄用として人工臓器(ストーマ)や、代用膀胱を埋め込むなどの必要もある。ストーマは袋を取り付けて定期的に交換する必要があるし、代用膀胱に至っては数日に1度は洗浄を行う必要があるなど、患者のQOL(生活の質)が著しく低下してしまうことになる。
新たながん治療として期待される「核酸医薬」
そうした中、この膀胱がんを早期の段階で治療できる可能性がある療法として期待されているのが「核酸医薬」だ。核酸医薬はDNAやRNAなどの「核酸」を医薬品として利用するものである。抗がん剤としては、がん細胞と正常細胞の区別を付けて、がん細胞だけに効果を現す(がん細胞の増殖を抑える)「分子標的医薬」に分類される。分子標的医薬の研究開発は、低分子医薬、高分子医薬(抗体医薬)と進められてきており、核酸医薬(中分子医薬)は最も新しいものになる。
低分子医薬は化学合成しやすいが、正常細胞にも影響を与えてしまう可能性が高く副作用が多いことが知られている。一方の高分子医薬は、ヒトの体内で生産されるタンパク質などの高分子を用いるが、分子数が多いため製造が難しく、高コストであるといった課題がある。
低分子医薬、高分子医薬ともに課題がある中、核酸医薬は標的だけに作用することから副作用の心配が少なく、また化学合成で製造できるためコストを抑えられるという特徴がある。e-NA Biotecで研究開発が進められているマイクロRNA医薬も、この核酸医薬の一種である。
マイクロRNA医薬は、生命活動の根幹を成す「セントラルドグマ」の工程において作用する、文字通り小さなRNAである「マイクロRNAを」活用する。セントラルドグマとは、膨大な長さを持つDNAから必要な情報だけを「メッセンジャーRNA」(mRNA)に転写して、それを設計図としてさまざまなタンパク質に翻訳(生産)する細胞内における生命活動の流れのこと(DNAから直接タンパク質を生産する仕組みではない)。そしてマイクロRNAは、mRNAからタンパク質が生産される際に働きかけを行う、生命活動にとって重要な存在である。
マイクロRNAががんを抑制する仕組み
北出氏は、このマイクロRNAの研究に20年(マイクロRNAを含めた核酸医薬の開発には35年以上)という長きわたって関わってきた経緯があり(200報以上の論文を発表)、その蓄えた知識を活用して研究開発が進められているのが、e-NA Biotecが開発しているマイクロRNA医薬なのである。
-
北出氏とe-NA BiotecのマイクロRNA医薬の研究の歴史。図中にはないが、北出氏は1982年に研究を開始したという。右下にあるのが、RASネットワーク(ここではKRASおよびc-myc)に対するmiR-143(およびmiR-145)の効果を表した模式図 (出所:e-NA Biotec事業概要資料)
マイクロRNAはさまざまな生物においてこれまで無数に発見されており、ヒトのマイクロRNAだけでも3000種類以上ある。そのうちの約10%に当たるおおよそ300種類が、がんや疾患と関連していることが分かってきており、その中でも北出氏が着目したのは「miR-143」だという。
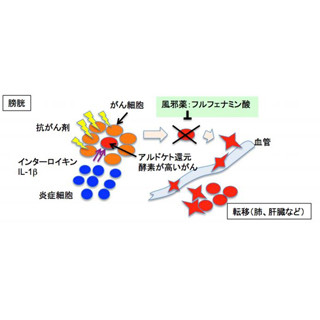
がんができると、マイクロRNAは発現が上昇するものもあれば、低下するものもある。膀胱がんに加えて、肺がん、胃がん、結腸直腸がん、前立腺がん、子宮頸がん、B細胞リンパ性白血病において共通して減少するのがmiR-143で(もう1つ、miR-145も同様に減少することが確認されている)、miR-143の発現が低下すると、がん遺伝子といわれる「RAS」(変異RASも含む)や「c-myc」などのがん促進タンパク質のネットワークが形成されてしまう。RASは幾種類かあり、膀胱がんでは「HRAS」が関連しているとされる。
一方、miR-143を増加させると、RASや変異RASによるがん促進タンパク質が減少することも分かっており、こうした研究結果からmiR-143はがんを抑制する効果のあるマイクロRNAであると考えられている。miR-143がmRNAと結合することで、RAS遺伝子からmRNAを経てRASタンパク質が翻訳される過程を阻害している(「RNA干渉」と呼ばれる現象)と考えられたことから、北出氏はmiR-143を外部から補充してやることで、mRNAと結合する量を増やせばがんを抑制できるのではないかと思いついたという。
-
セントラルドグマ(図中でゲノムDNA→mRNA→Proteinとある流れ)と、マイクロRNAの働きかけ(=マイクロRNA医薬)を表した模式図。RAS遺伝子から転写されたmRNAを用いてRASタンパク質(がん促進タンパク質)が翻訳されてしまうところを、miR-143がRNA干渉によって阻害することで、RASタンパク質の生産を防ぐ仕組みだ (出所:e-NA Biotec事業概要資料)
これまでの分子標的医薬では、RASおよび変異RASが作り出すがん促進タンパク質自体がターゲットとされてきた。しかし、このタンパク質は構造的に結合することが難しく(阻害剤のポケットがない)、変異RASも複数あることが問題とされていた。また、RASだけを抑制しても、RAS周辺のネットワークがあるため、それらに対しても効果がないと、一時的な抑制しかできないという最大とも言える問題があり、RASだけを狙っていたのではがんを抑制できないとされてきた。
しかし、miR-143ならRASとその周辺ネットワークに対してまとめて作用するという効果を有する。miR-143を利用するマイクロRNA医薬は核酸医薬には分類されるが、がんの治療方法としては画期的なものと言える。
ヒトへの適用に向けた取り組み
ただしmiR-143を補充するといっても、そのままでは生体内での安定性の問題があることから、実用という面では簡単ではない。そこで、miR-143の安定性を高めるため、化学修飾を施し、それを(化学修飾されたmiR-143)、がん病巣まで送り届けることができるナノカプセルに封入。生体内での安定性の高いmiR-143をがんまで確実に届けるようにしたのが、e-NA Biotecで開発された核酸医薬「ラスミヤ143」だという。
北出氏は、岐阜大 大学院連合創薬医療情報研究科の赤尾幸博特任教授との共同研究により、ラスミヤ143を開発。すでに日米において特許が取得されており、中国およびEUでも特許出願中だ。今後は医薬品としての販売に向け、臨床試験などが行われていく計画だ。具体的には、まず新規物質の有効性・安全性の研究、管理基準に基づく製剤化などの非臨床試験が数年かけて進められる。
-
ラスミヤ143研究のマイルストーン。膀胱がんのための局所投与に関する基礎研究はほぼ完了し、これから非臨床試験の段階となる。その後、少人数のヒトでの予備的臨床試験を経て、本格的な臨床試験が実施される (出所:e-NA Biotec事業概要資料)
ヒトで使用して問題ないと判断されれば、続いて、ラスミヤ143開発の協力者である大阪医科薬科大学 泌尿器科の東治人教授のもとにて、少人数の患者に対してヒトでの有効性の検証(予備的臨床試験)が実施される。
そこでも安全性や効果などがきちんと確認されれば、いよいよ人数を増やした臨床試験となる。フェーズ1~3の3段階で行われ、すべて問題がなければ、承認申請となり、無事承認を取得した後、販売が実現するという流れだ。計画では、まだ少し先になるが、2028~2029年ごろの販売を見込んでいるという。
現在は、マウスを用いた試験が行われ、その有効性が確認されている段階だ。筋層非浸潤性膀胱がんのモデルマウスに対し、ラスミヤ143を全身投与、もしくは膀胱腔内への居所投与が実施された結果、投与していないコントロール群に対し、有意に腫瘍が減少することが確認されたという。
-
筋層まで腫瘍が広がっていない早期膀胱がんのモデルマウスに対する、miR-143およびラスミヤ143を用いた実験結果。(左上)miR-143の全身投与の場合。グラフ中の黒線が投与されていないコントロール群で、青および黄の投与されたマウスはがんが大きく減少している。(左下)膀胱腔内投与の結果。こちらもグラフから投与による大きな差が見て取れる。(右)ラスミヤ143の投与でも腫瘍が有意に減少したことが確認されたとした (出所:e-NA Biotec事業概要資料)
ただし、もちろんマウスで有効だからすぐにヒトにも使用できるかというと、それはまだ100%ではない。マウスとヒトでは異なるところも多々あるため、医薬としての有効性と安全性の問題の点から確実に調査をする必要がある。そのため、予備的臨床試験の段階に進むだけでもまだ数年かかるというわけである。
膀胱がん以外のがん治療への応用も期待
またmiR-143は、上述したように膀胱がん以外でも発現が低下することがわかっている。このことから北出氏らは、それらのがんでもmiR-143を補充すれば、抑制できる可能性があると考えられるとしており、すでに難治性大腸がん向け基礎研究も開始。今後は難治性膵臓がんなども基礎研究を進める計画だという。これらのがんでは膀胱がんのような局所投与ではなく、全身投与での利用が検討されており、2030年代半ば以降の実現が目指されている。
なお、ラスミヤ143の早期膀胱がんのターゲット患者は、世界で約14万人と見積もられている(今後、増加していく傾向にある)。適用できるがんの種類や方法が拡大していけば、年間平均売り上げ1000億円も期待できると同社では試算している。今回の資金調達は、そうした新たな治療方法のヒトへの適用を現実のものにするための第一歩と言えるだろう。
ちなみにe-NA Biotecのe-NAとは、excellent(優れた)のeに、DNAやRNAのNAと同じ核酸を意味するNucleic Acidの頭文字を付けたものだという。社名として「イーエヌエイ」が正しい読み方だが、実はもう1つの読み方がある。e-NA BiotecのマイクロRNA医薬に対して、患者から思ってもらえる「いいな(ええな)」だ。e-NA Biotecと北出氏の研究は、その2つの意味を持ってがん治療のパラダイムシフトを実現するべく、これからも進められていく。