東京都立大学(都立大)、理化学研究所(理研)、科学技術振興機構(JST)の3者は9月13日、細胞が外部からの信号を正確に受け取り、それをDNAに伝える過程を支える重要なタンパク質の「GRB2」と「SOS1」がどのように結びつき、体内のさまざまな過程を調整しているのかを分子レベルで解明したと共同で発表した。
同成果は、都立大大学院 理学研究科の館野圭太大学院生(研究当時)、同・菅澤はるか研究員、同・池谷鉄兵准教授、同・伊藤隆教授、理研 生命機能科学研究センターの美川務専任研究員らの共同研究チームによるもの。詳細は、英国王立化学会の機関学術誌「Chemical Science」に掲載された。
細胞が外部からのシグナルを受け取ってDNAに正確に伝える過程は、「細胞内シグナル伝達」と呼ばれる。その過程の上流で中心的な役割を果たすのが、GRB2やSOS1など。GRB2は細胞膜にある受容体からシグナルを受け取り、それをSOS1に伝達。SOS1はそれを分子「RAS」に伝え、最終的に核内のDNAにまで情報を伝達することで、細胞はそれに応じた反応を引き起こすのである。しかしこれまで、GRB2とSOS1がどのようにタンパク質間の相互作用を起こし、外部からのシグナルがDNAにどのように伝わるのか、その詳細は十分にわかっていなかったという。
-
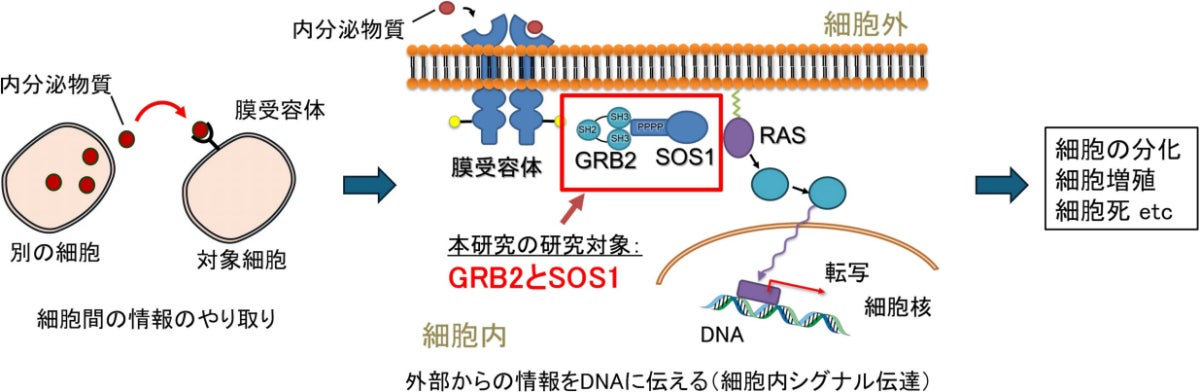
細胞内シグナル伝達とGRB2-SOS1。細胞は、別の細胞から放出された内分泌物質を受け取り、さまざまなタンパク質を用いて、その情報をバケツリレーのようにして核内のDNAにまで伝える。DNAは届いた情報を基に、分化、増殖、細胞死などの応答を起こす。GRB2とSOS1は、この細胞内シグナル伝達の最初の伝達役を担う(出所:都立大Webサイト)
また近年、GRB2とSOS1は液液相分離現象を起こすことで、シグナル伝達の制御をより精密に行っている可能性が示唆された。しかし、両タンパク質がどのように集合と離散を起こし、巨視的な液滴の形成と消失を起こしているのかについては、分子・原子レベルでほぼ未解明だったとする。その理由の1つは、両タンパク質が通常よりも柔らかな領域を広く持つために、X線結晶構造解析やクライオ電子顕微鏡などの一般的に活用されている解析法の適応が難しかったためだ。そこで研究チームは今回、この未解明の過程を分子レベルで解明し、細胞内シグナル伝達の全体像をより明らかにすることを目指すことにしたという。
今回の研究では、運動性が大きく柔らかな領域を持つタンパク質においても、それらの構造や運動性の大きさと速度の解析が可能な核磁気共鳴スペクトル法(NMR)が用いられ、GRB2やSOS1の相互作用の様式や強さが詳細に解析された。また今回は、NMRデータから分子間結合の強さを、最も可能性のある結合モデルを選択して値を推定するという、新たな計算手法も開発された。
GRB2は、機能部位(ドメイン)が3つ(NSH3、SH2、CSH3)接続した構成だ。従来研究から、NSH3とCSH3がSOS1との相互作用に関わることがわかっていたことから、両者はSOS1に対してほぼ同一に関与すると考えられてきた。しかし今回の解析により、NSH3のSOS1への結合親和性はCSH3と比較して10~20倍も強いことが判明。これにより、NSH3とCSH3では異なる役割を持つことが示唆されたとした。
また、NSH3とCSH3の運動性も大きく異なっていることが確認され、ここからSOS1との相互作用の様式もドメイン間でかなり異なることが解明された。この発見は、細胞内でのGRB2とSOS1によるシグナル伝達機構が、これまでの理解よりもはるかに複雑で、シグナルの強さや種類に大きく影響を与える可能性があることを示唆しているという。
-
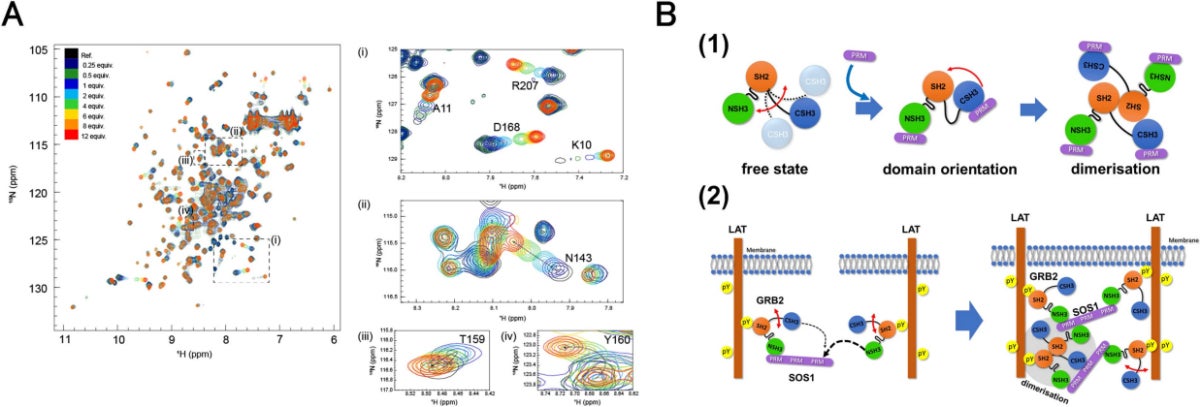
NMRを用いたGRB2-SOS1の相互作用解析。(A)窒素15安定同位体標識を用いた、GRBとSOS1のMNR滴定実験。NMR信号の変化を解析することで、両タンパク質との統合領域の変化を観測できる。(B)NMR解析から得られたGRB2-SOS1相互作用モデル。CSH3はNSH3に比べて大きく動いている。SOS1の結合領域(PRM)と2つのSH3ドメインが結合すると、ドメインの配置が大きく換わり、2量体化が起こる(1)。NSH3とCSH3の結合の強さが異なることで、GRB2は複数のSOS1をつなげるブリッジの役割を果たし、液液相分離が起こる(2)(出所:都立大Webサイト)
さらに近年になって、GRB2とSOS1が液液相分離を引き起こすことで、細胞内シグナル伝達を微調整している可能性が示唆されている。そこで、両タンパク質の複雑な相互作用様式と液液相分離との関係が注目され、両タンパク質の相互作用モデル「LLPS(液液相分離)形成機構」が、以下の通りに推測された。
- GRB2が単独で存在する際は、GRB2のCSH3ドメインは大きく揺らいでいる。NSH3とCSH3がSOS1の結合領域と相互作用すると、CSH3ドメインの位置が大きく変化し、GRB2の2量体化が促進される。
- GRB2のNSH3とCSH3のSOS1への結合親和性は10~20倍異なるため、SOS1の1分子が持つ複数の結合部位に対して結合ステップが異なり、結果的にGRB2が複数のSOS1を架橋する構造を取る。これにより複数の分子が1か所に集合し、全体として液液相分離を引き起こすことが考えられるとした。
今回の研究で、中でもGRB2が液液相分離を介してシグナル伝達の強度を調節する可能性が示唆されたことから、この発見は細胞内シグナル伝達の異常によって起こるがんなどの病気の新しい治療法の開発につながる可能性があるとした。またNMRの活用により、従来手法では観察できなかった動的なタンパク質相互作用を高解像度で観察できることが示され、今後の生物物理学的研究にも大きな影響を与えることが期待されるとしている。