千葉大学は4月22日、腎臓の「糖新生」を制御する新たなメカニズムの解明に成功し、空腹時の血糖維持に関わる腎糖新生の調節に肝臓で合成される「ケトン体」が、空腹時の代替エネルギー源としてだけでなく、生理活性物質として血糖調節や血液の酸性化(アシドーシス)を防ぐという重要な役割を担っていることを新たに発見したと発表した。
同成果は、千葉大大学院 医学研究院の波多野亮助教、同・三木隆司教授、同・田中知明教授、同・平原潔教授、千葉大大学院 薬学研究院の佐藤洋美准教授らの共同研究チームによるもの。詳細は、代謝に関する全般を扱う学術誌「Molecular Metabolism」に掲載された。
糖新生は、空腹(飢餓)時にエネルギー源であるブドウ糖(グルコース)を補うため、体内のアミノ酸や乳酸、グリセロールなどの異なる栄養素から糖を作り出す経路のことであり、空腹期間が続いても、血糖値を一定に保つための重要な生理機能の1つだ。
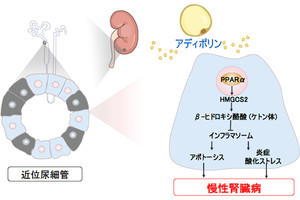
その糖新生を行う主な臓器として、これまでは肝臓が考えられていたが、最近では腎臓が同機能を持つもう1つの臓器として注目されるようになってきた。しかし、腎臓の糖新生を調節するメカニズムには不明な点が多く、どのように調節されているのかはまだ十分に解明されていなかったという。そこで研究チームは今回、マウスにおいて腎臓の糖新生に関わる遺伝子の発現と血中の「ケトン体」(ここでは主たるケトン体である「β-ヒドロキシ酪酸」(BHB)を指す)濃度との間に相関関係があることを見つけ、ケトン体による腎臓の糖新生の調節について検証することにしたとする。
ケトン体とは、飢餓時に不足したブドウ糖の代わりに、代替エネルギー源として遊離脂肪酸から合成される化合物のことで、上述したように、BHBが最も多いが、「アセト酢酸」、「アセトン」と合わせた3分子がケトン体と総称されている。今回の実験では、マウスを用いて、ケトン体に関する分析が行われた。
空腹時のマウスの血中ケトン体濃度が腎臓の糖新生関連酵素である「G6pc1」や「Pck1」の遺伝子発現と相関したことから、空腹時に高ケトン血症を示す肥満マウスやインスリン抵抗性を示すマウスでの調査が行われた。すると、G6pc1やPck1発現がさらに上昇することが確認されたという。また、ケトン体の投与やケトン食の給餌によっても血中のケトン体濃度に比例して腎G6pc1、Pck1遺伝子発現が上昇することが確認された。
その一方で、ケトン体合成が障害された、「α型ペルオキシソーム増殖活性化受容体」(肝臓では脂肪酸のβ酸化やケトン体生成に関連する遺伝子の発現を調節する転写因子として働く)を欠損したマウスでは、空腹時に腎糖新生が誘導されず、空腹時低血糖を呈することが判明した。ただし、ケトン体の投与により、この空腹時低血糖を改善することができたという。これらの結果から、ケトン体が腎臓の糖新生を調節する重要なレギュレーターであることが考えられるとした。
続いて行われた培養細胞での実験においても、ケトン体刺激により、細胞内のアミノ酸の異種の「グルタミン」を利用したブドウ糖合成が促されることが突き止められた。また、腎糖新生はグルタミンを利用して尿中に「アンモニウム」(NH4+)として酸を排泄する役割も担っているが、マウス尿細管を用いた実験では、ケトン体はグルタミンからのアンモニア(NH3)産生とブドウ糖産生を亢進させることが確認されたとする。このことから、ケトン体は腎糖新生を調節することで、血糖と酸・塩基平衡の調節をしていることが考えられるとした。
ケトン体の血中濃度の上昇は肥満症患者や糖尿病患者においても見られ、今回発見された腎糖新生を調節するメカニズムは、これらの患者における空腹時高血糖の一因となる可能性があるという。1型糖尿病患者で見られる「糖尿病性ケトアシドーシス」は、ケトン体による腎臓における酸・塩基調節機能の能力を上回る量のケトン体が産生されてしまうことによって、生じるものと考えられるとする。その一方で、ケトン体合成機能が低下した脂肪酸代謝異常症では、空腹時低血糖や代謝性アシドーシスが生じることから、正常な生理機能の維持においても、ケトン体を介した腎糖新生制御機構が重要であるものと考えられるとした。
今回の研究成果は、腎臓の糖新生が果たす生理学的役割や肥満症、糖尿病、脂肪酸代謝異常症などの疾患における血糖調節異常などの原因を明らかにすると共に、新たな治療法の開発につながることが期待されるとしている。